Forschungsschwerpunkte und Projekte AG Rau (for english scroll down)
Unsere Forschungsarbeit konzentriert sich auf die zelluläre Zusammensetzung und Interaktionen im Tumormicroenvironment bei verschiedenen soliden Tumoren. Insbesondere leicht zugängliche morphologische Parameter wie Tumorbudding und tumorinfiltrierende Lymphozyten (TIL) werden mit räumlichen Multiplex-Experimenten und einer Korrelation mit bekannten molekularen Parametern eingehender analysiert. Durch den Konzepttransfer zwischen verschiedenen Entitäten konnten wir Kohorten von kolorektalem Krebs, Endometriumkarzinom, Lungenkrebs, Brustkrebs etc. untersuchen. Unser Engagement für Biobanking-Verfahren und moderne digitale Tissue-Microarray-Technologien fördert die Zusammenarbeit mit verschiedenen Klinikpartnern.
In den letzten Jahren hat sich das Endometriumkarzinom zu einer der interessantesten Entitäten für unsere Forschungsgruppe entwickelt. Denn die relativ neuen vier molekularen Subtypen Polymerase Epsilon mutiert, Mismatch repair protein defizient, TP53 mutiert und die sogenannten Tumoren mit unspezifischem Mutationsprofil unterscheiden sich in der Prognose enorm. Zusammen mit unseren Kooperationspartnern u.a. vom Karolinska Institut, der Universität Leiden und dem Inselspital Bern ist es uns gelungen, die pathogenen POLE-Mutationen besser von den Varianten unbekannter Bedeutung (VUS) zu trennen. Insbesondere die sogenannten Multiple Classifier Karzinome veränderten die molekulare Teststrategie für die klinische Routine, da sich diese molekularen Befunde in bis zu 3% der Fälle nicht gegenseitig ausschließen. POLEmut-Veränderungen dominieren gegenüber MMRdef- und diese wiederum gegenüber P53mut-Fällen, was eine POLE-Mutationsanalyse für eine vollständige molekulare Signatur des Endometriumkarzinoms unumgänglich macht.
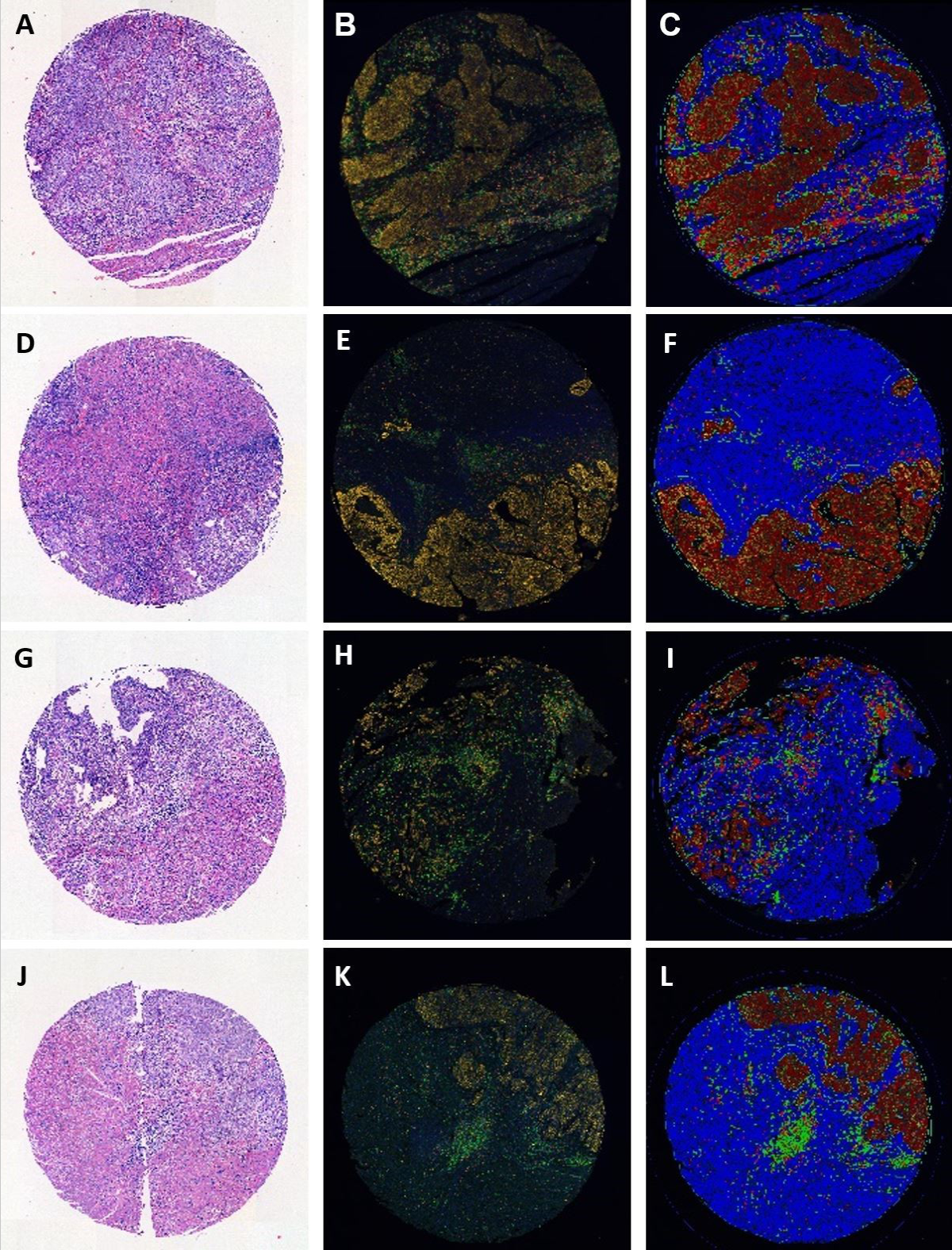
Interessant ist, dass sich die verschiedenen molekularen Subtypen in der Bildung von Tumorbudding unterscheiden, die eher bei TP53aberranten Fällen auftreten. Im Gegensatz dazu ist die TIL-Bildung ein interessanter Parameter für POLEmut-Fälle, kann diese aber quantitativ nicht eindeutig von MMRdef-Fällen unterscheiden. Der umgekehrte Befund ultraniedriger TIL-Dichten in POLE-Wildtyp-Fällen könnte jedoch von klinischem Nutzen sein, um eine Sequenzierung in Fällen zu vermeiden, in denen mit hoher Wahrscheinlichkeit keine Mutation vorliegt. Die präzise Quantifizierung mit Multiplexing-Techniken und die Anwendung von Tools wie QuPath, Image J usw. dienen der Beantwortung dieser Fragen und werden mit Kollaborationspartnern auf dem Campus und darüber hinaus durch computergestützte Ansätze weiter ausgebaut.
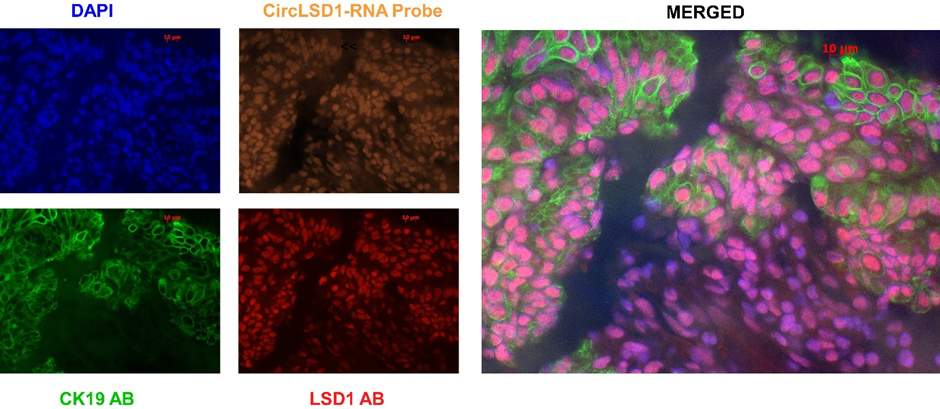
Neben der klinisch-pathologischen Korrelation wird derzeit auch eine funktionelle Perspektive auf diese Veränderungen des Tumormicroenvironments entwickelt. Dazu werden neue Zielgene untersucht, die an der Expression relevanter lymphozytärer Biomarker wie PDL1 beteiligt sind. Insbesondere wird eine Verbindung zu LSD1 (lysinspezifische Demethylase) untersucht, die die Genexpression epigenetisch moduliert. Maria Anokhina begann diese Arbeit in der Gruppe von Prof. Odenthal (Institut für Pathologie, Universität Köln). Dabei wurden zirkuläre LSD1-RNA-Moleküle, die Produkte des Back-Splicing von LSD1-pre-mRNA, entdeckt und es wurde vermutet, dass sie die Expression der parentalen LSD1-mRNA kontrollieren.
Die unterschiedlichen relativen Expressionsniveaus der LSD1 cirRNAs und des LSD1-Proteins in Tumor- und Nicht-Tumorgewebe ermöglichen es uns, sie als wichtige und zellspezifische Marker für die Karzinogenese einzuordnen. Als neuartige in-situ-Technik konnten wir an unserem Standort erfolgreich eine kombinierte Immunfluoreszenz- und circRNA-in-situ-Hybridisierungstechnik installieren. Die circRNAs tragen zum Exosom bei und sind somit direkt mit der Zell-Zell-Kommunikation verbunden, die nun im Endometriumkarzinom und seinen Vorläuferläsionen untersucht werden kann. In zukünftigen Zellkulturexperimenten wollen wir Unterschiede in diesen Regulatoren in Abhängigkeit von den molekularen Befunden und verschiedenen Co-Faktoren wie z.B. hormoneller Stimulation untersuchen.
Our research work is focusing on the cellular composition and interactions in the tumor microenvironment in several solid tumors. Particularly, easy to access morphological parameters like tumor budding and tumor infiltrating lymphocytes are analyzed in more depth with spatial multiplexing experiments and a correlation with known molecular parameters. Transfer of concepts between entities enabled us to investigate cohorts of colorectal cancer, endometrial carcinoma, lung cancer, breast cancer and others. Our dedication to biobanking procedures and modern digital tissue microarray technologies fosters collaborations with different clinic partners.
In recent years endometrial carcinoma evolved to one of the most interesting entities for our research group. This is as the relatively new four molecular subtypes of Polymerase Epsilon mutated, Mismatch repair protein deficient or TP53 mutant and the so-called non specific mutational profile tumors differ tremendously in prognostics. We together with our collaboration partners e.g. of the Karolinska Institute, the University of Leiden and the Inselspital University Hospital Bern achieved a better separation of pathogenic POLE mutations from variants of unknown significance (VUS). Particularly, the so-called multiple classifier carcinomas changed the molecular testing strategy for clinical routine, as these molecular finding are in up to 3% of cases not mutually exclusive. POLEmut changes dominate over MMRdef and those again over P53mut cases, which makes POLE mutation analysis inevitable for a complete molecular signature of endometrial carcinoma.
Of interest, the different molecular subtypes differ in the formation of tumor buds, which are more likely to occur in TP53 aberrant cases. In contrast, TIL formation is an intriguing parameter of POLEmut cases, but is quantitatively not able to separate them clearly from MMRdef cases. However, the inverse finding of ultralow TIL densities in POLE wildtype cases might be of clinical use to avoid sequencing in cases very likely to be not mutated. Precise quantification with multiplexing techniques and application of tools like QuPath, Image J etc. takes place to answer these questions and is further extended with computational approaches in collaboration on the campus and beyond.
Beside the clinic-pathological correlation a more functional perspective of these changes of the tumor microenvironment is currently installed. Therefore, novel target genes involved in the expression of relevant lymphocytic biomarkers like PDL1 are investigated. In particular, a connection to LSD1 (lysine specific demethylase) pathways are investigated, which epigentically modulate gene expression. Maria Anokhina started this work at the group of Prof. Odenthal (University Cologne). Herein, LSD1 circular RNA molecules, the products of back-splicing from LSD1 pre-mRNA, were discovered and suggested to control expression of the parental LSD1 mRNA.
Different relative expression level of LSD1 cirRNAs and LSD1 protein in tumor versus non-tumor tissue allows us to use them for the important and cell specific markers of the cancer development. As novel in-situ technique at our site we could successfully install a combined immunofluorescence and circRNA-in situ hybridization technique. The circRNAs are contributing to the exosome and are therefore directly linked to cell-cell-communications, which now can be investigated in endometrial carcinoma and its precursor lesions. In future cell culture experiments we want to investigate differences in these regulators in dependency from the molecular findings and different co-factors like hormonal stimulation.


