Fanconi-Anämie
Fanconi-Anämie (FA) ist eine seltene angeborene, autosomal rezessive Erkrankung, die klinisch durch die Trias multipler angeborener Fehlbildungen, einem chronisch progredientem Knochenmarksversagen und einer Neigung zur Ausbildung bösartiger Erkrankungen (Leukämien, solide, epitheliale Tumore vor allem der Schleimhäute wie Kopf-Hals-Karzinome) charakterisiert ist. Ausserdem leiden die Patienten unter endokrinologischen Fehlregulationen.
Pathogenetisch gehört die FA zu den DNA-Reparaturerkrankungen. Auf zellulärer Ebene ist die Fanconi-Anämie durch eine chromosomale Instabilität und eine erhöhte Empfindlichkeit für Chemotherapeutika gekennzeichnet, deren Wirkungsweise auf einer Hemmung der DNA-Replikation durch Querverknüpfungen (Inter- und Intrastrang-Vernetzungen) zwischen den beiden DNA-Strängen beruht, wie das für Cisplatin oder Mitomycin C (MMC) der Fall ist (D´Andrea, 2003). Dieser Defekt wird durch Mutationen (Veränderungen der DNA) in einem der FA-spezifischen Gene verursacht. Insgesamt sind bisher mindestens 15 rezessive Gene (FANC-A/B/C/D1/D2/E/F/G/I/L/M/N/O/P) identifiziert worden, bei denen biallelische Keimbahndefekte zum klinischen Erscheinungsbild einer Fanconi-Anämie (FA) führen.
Alle FA-Gene werden zur erfolgreichen DNA-Reparatur nach Schaden durch DNA-Doppelstrang verknüpfende Chemotherapeutika benötigt. Ein defektes Gen kann nicht durch Überexpression eines anderen FA-Gens kompensiert werden. Die häufigesten betroffenen Gene sind Fanc A (65%), FancC (15%) und FancG (10%), wobei FanC mit der ungünstigsten Prognose assoziiert ist (Kutler, 2003). Aufgrund dieser unzureichenden Reparatur der DNA-Schäden kommt es zu einer deutlich gesteigerten Apoptose (Suizid der Zelle) auf allen Ebenen des hämatopoetischen Systems. Die Apoptose insbesondere der Stammzellen resultiert über Jahre hinweg in einem kontinuierlichen Verlust an Stammzellen im Knochenmark, so dass die Patienten aufgrund des fehlenden Nachschubs reifer, funktionsfähiger Blutzellen klinisch durch eine vermehrte Infektionsneigung (Granulozytopenie), durch eine besondere Blutungsneigung (Thronbozytopenie) und/oder durch eine ausgeprägte Anämie charakterisiert sind. Bei 80% der Fanconipatienten kommt es zu einem Knochenmarksversagen, was mit einer kumulativen Wahrscheinlichkeit von 90% einhergeht, im Alter von 40 Jahren ein Knochenmarksversagen zu entwickeln. Über 20% der Fanconipatienten entwickeln im Laufe Ihres Lebens Neoplasien. 60% dieser Malignome sind hämatologischer Ätiologie, 40% andere, vor allem epitheliale Karzinome.
Durch eine Knochenmarkstransplantation können heute in relativ viele Fällen die hämatologischen Erkrankungen erfolgreich therapiert werden (Kutler, 2003).
Molekulabiologische Diagnostik im Verdachtsfall
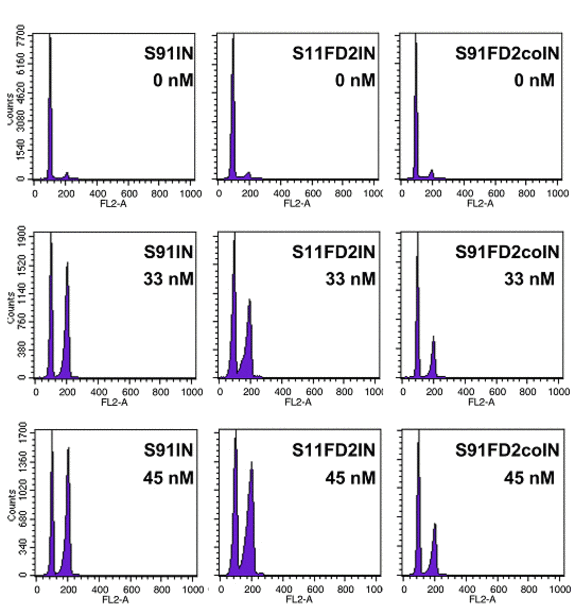
Exponiert man FA-Zellen mit DNA-Strang vernetzenden Chemotherapeutika in einer Dosis, die von normalen Zellen noch gut toleriert wird, kommt es zu einem charakteristischen zellulären Phänotyp. Er zeichnet sich durch G2/M Arrest und nachfolgendem apoptotischen Zelltod aus. Durchfluß-zytometrische Zellzyklusanalysen nach relativ geringen Mengen an MMC oder Cisplatin-Exposition zeigen bei Zellen von Fanconipatienten eine erhöhte Sensitivität. In der FACS-Messung imponiert dies alsZellzyklusarrest mit einer deutlichen Vermehrung des relativen Anteils an Zellen, die sich in der S- und G2-Phase befinden.
Führt man einen Western-Blot für das FancD2-Protein durch, können bei regulärer Aktivierung des Proteins durch Ubiquitinierung 2 Banden dargestellt werden, die das ubiquitinierte und das nicht-ubiquitinierte FancD2-Protein darstellen. Sind „frühe“ Fanconigene bei Vorliegen eines FAnconi-Defekts betroffen, die zum Proteinkomplex gehören, der zu einer Ubiquitinierung von FAncD2 und FancI führt, kann im FANCD2- oder FANCI-Western-Blots das Fehlen einer Doppelbande dargestellt werden.
Durch Transduktion der Fanconi-verdächtigen Zellen mittels retroviraler Vektorsysteme, die die unterschiedlichen FA-Gene in den Zellen exprimieren, können die betroffenen Gene identifiziert werden. Wird das betroffene Gen in die Zelle transduziert, so kann hierdurch die erhöhte Empfindlichkeit auf kreuzvernetztende Chemotherapeutika wieder normalisiert werden. Im FACS imponiert dann nicht mehr der Zellzyklusarrest mit einem erhöhten Anteil an Zellen in der S- und G2-Phase.
Sind frühe Gene betroffen, kann dies ausserdem im FancD2-Western-Blot nachgewiesen werden. Bei Zellen, die mit dem betroffenen Gen transduziert wurden, wird seine Funktion wieder hergestellt und eine FAncD2-Monoubiquitiierung ist wieder möglich. Es sind 2 Banden im FancD2-Western-Blot sichtbar.
Diese molekularbiologische Diagnostik der Fanconi-Anämie ist in unserem Labor gut etabliert und gehört zu unserem Standard.