Tumorforschung
Radiojodtherapie reduziert die Anzahl zirkulierender Tumorzellen im peripheren Blut von Schilddrüsenkarzinom-Patienten Schmidt M. et al., Clinical Endocrinology 2021
In einer 2021 publizierten Studie konnte erstmals gezeigt werden, dass eine Radiojodtherapie eine Reduktion von zirkulierenden Tumorzellen im peripheren Blut von Schilddrüsenkarzinom-Patienten bewirkt. In die Studie wurden Patienten mit verschiedenen Tumorerkrankungen eingeschlossen einschließlich Patienten mit einem PTC, FTC und FV-PTC.

Abb.: Repräsentatives mikroskopisches Bild zirkulierender Tumorzellen im peripheren Blut
Erhöhte Anzahl von zirkulierenden Tumorzellen bei Schilddrüsenkarzinom-Patienten Ehlers M. et al., Horm Metab Res 2019
Ehlers M. et al., Horm Metab Res 2019
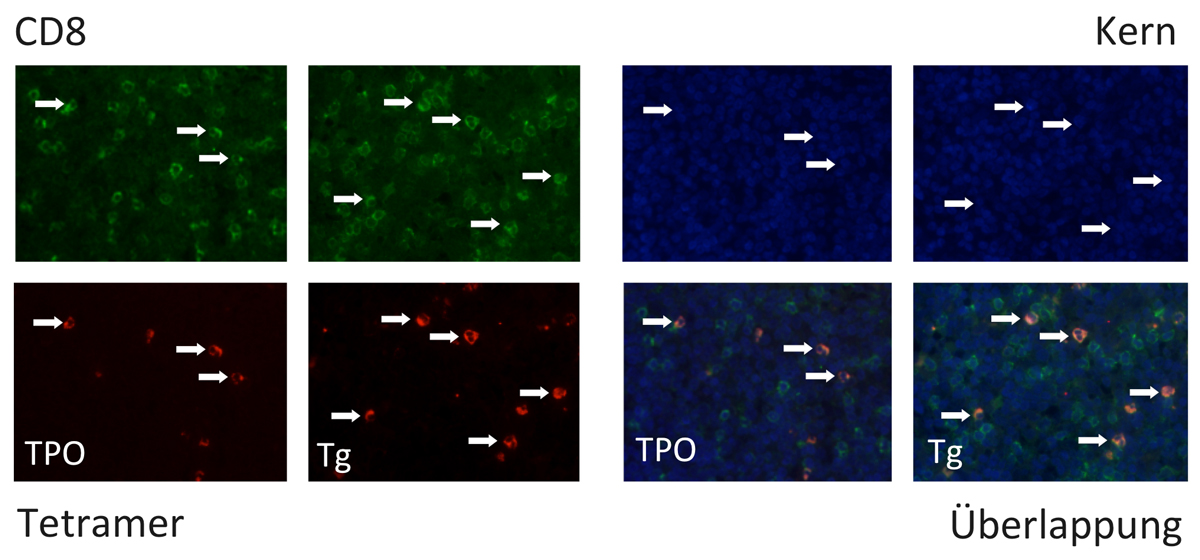
Epitop-spezifische zytotoxische T-Zellen unterdrücken die Tumorausbreitung beim papillären Schilddrüsenkarzinom
Ehlers M et al., J Clin Endrinol Metab 2017
In einer 2017 publizierten Studie konnten wir erstmals zeigen, dass Epitop-spezifische T-Zellen die Ausbreitung von Tumorzellen bei Patienten mit papillärem Schilddrüsenkarzinom unterdrücken. Es wurden insgesamt 150 Patientin mit papillärem Schilddrüsenkarzinom untersucht. Es erfolgte eine HLA-Typisierung sowie eine Messung von Tumor-spezifischen T-Zellen mittels Tetrameranalyse. Es konnte gezeigt werden, das PTC-Patienten mit dem HLAHaplotypen DQB1*03 ein signifikant geringeres Risiko für eine periphere Metastasierung haben. Bei diesen Patienten war zugleich eine Epitop-spezifische zytotoxische Immunität gegen die Moleküle Thyreoglobulin und Thyreoperoxidase nachweisbar. Diese Zellen waren auch in den betroffenen Lymphknoten nachzuweisen. Die Arbeit stellt eine Basis für eine zukünftige Immuntherapie bei Radiojod-refraktären PTC-Patienten dar.
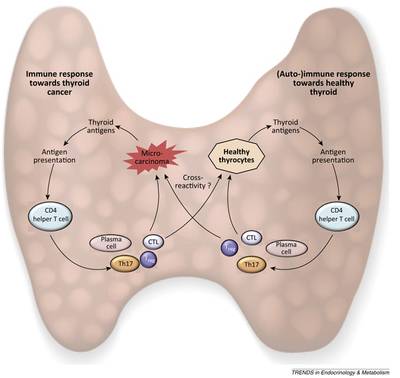
Autoimmunität und Malignität der Schilddrüse: Gibt es einen immunologischen Zusammenhang?
Ehlers et. al., Trends Endocrinol Metab. 2014
Die Hashimoto Thyroiditis (HT) ist die häufigste Autoimmunerkrankung der Schilddrüse. Demgegenüber steht das papilläre Schilddrüsenkarzinom (PTC); dieses ist u.a. gekennzeichnet durch eine lymphozytäre Infiltration. In einem Übersichtsartikel tragen wir die aktuellen Erkenntnisse bezüglich der Immunreaktion bei der HT zusammen und diskutieren den potenziellen immunologischen Zusammenhang zwischen der Autoimmunthyreoiditis und dem papillären Schilddrüsenkarzinom.
Zirkulierende Tumorzellen im peripheren Blut von Patienten mit neuroendokrinen Tumoren
Ehlers et. al., Horm Metab Res 2014
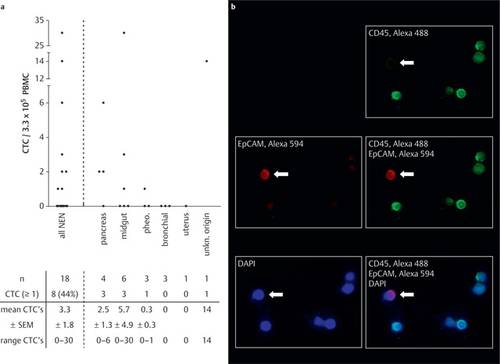
Eine grundlegende Voraussetzung für die Entstehung von Metastasen ist das invasive Wachstum eines Tumors. Es wird vermutet, dass neben Blut- und Lymphgefäßen auch die im peripheren Blut vorhandenen, zirkulierenden Tumor-Einzelzellen (ctc’s) eine wichtige Rolle spielen. Ctc’s können aufgrund der Existenz von charakteristischen Oberflächenmolekülen von den Zellen des Blutes unterschieden werden (siehe Abbildung). In unserer Studie wurden Patienten mit neuroendokrinen Tumoren untersucht. Bei betroffenen Patienten konnten ctc’s im peripheren Blut nachgewiesen werden, wobei auch ein Zusammenhang zur Metastasierung hergestellt werden konnte.
Abbildung A zeigt die Frequenz der ctc’s im peripheren Blut von allen untersuchten Patienten mit neuroendokrinen Tumoren und in den einzelnen Subgruppen. In Abbildung B ist eine repräsentative Färbung von Zellen des Blutes zu sehen. Hierbei wurden die Oberflächenmoleküle CD45 (grün) und EpCAM (rot) histologisch gefärbt. Die Zellkerne erscheinen blau (gefärbt mit DAPI). Ctc’s sind durch die charakteristische Existenz von EpCAM, aber der fehlenden Existenz von CD45 von den Zellen des Blutes zu unterscheiden. Der Pfeil deutet auf eine ctc
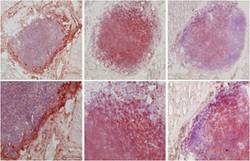
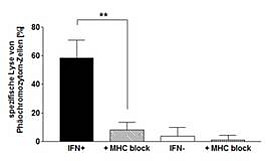
Chromogranin A als potentielles Tumorantigen für Immunotherapie bei neuroendokrinen Tumoren
Papewalis et. al., Mol Cell Endocinol. 2011
In dieser Arbeit konnte erstmalig gezeigt werden, dass das neuroendokrine Tumorzell-spezifische Oberflächenmolekül Chromogranin A (CgA) auch als Tumorantigen fungiert. Auf der Basis eines Mausmodells konnte bewiesen werden, dass nach Immunisierung mit CgA-Peptiden eine CgA-spezifische Immunität induziert wird. Dies führt zur Infiltration von ex vivo applizierten Tumorezellen (Abbildung A) und eine Lyse von Tumorzellen durch aktivierte (Interferon gamma-sezernierende) T-Lymphozyten (Abbildung B)