Von: C. Berndt, Redaktion
Nur fünf Aminosäuren bestimmen die Funktion von Glutaredoxinen in Eisenstoffwechsel oder Signalübertragung
Die Proteine der Glutaredoxin-Familie sind lebenswichtig. Es gibt von ihnen zwei Klassen, die zwar nahezu identische Strukturen aufweisen, aber dennoch unterschiedliche Funktionen haben. Unter Mitwirkung von Forschern der Düsseldorfer Arbeitsgruppe „Thiology“ an der Klinik für Neurologie konnte ein internationales Forschungskonsortium die molekularen Grundlagen, welche dieser unterschiedlichen Funktionen der beiden Klassen zugrunde liegen, ermitteln. Sie sind auf eine aus nur fünf Aminosäuren, den Bausteinen von Proteinen, bestehende Loop-Struktur zurückzuführen. Die Forschungsergebnisse wurden aktuell in der Zeitschrift Nature Communications veröffentlicht.
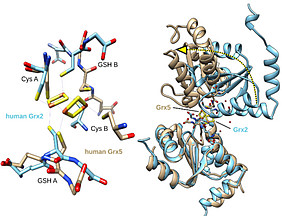
Die in nahezu allen Lebewesen vorkommende Glutaredoxin-Familie teilt sich in zwei Untergruppen auf. Beide Klassen sind wichtig für den Energiestoffwechsel in Zellen. Die Proteine der einen Gruppe (CxxS-Typ) sind unentbehrlich im zellulären Eisenstoffwechsel. Ist diese Klasse nicht mehr voll funktionsfähig, so führt dies zu einem Verlust wichtigster Eisen-Kofaktoren ohne die beispielsweise kein Sauerstoff im Blut transportiert werden kann. Die Proteine der anderen Untergruppe (CxxC-Typ) sind Oxidoreduktasen. Sie übertragen Elektronen und sind unter anderem unentbehrlich für die Gehirnentwicklung. Beispielhaft wurden zwei menschliche Proteine aus den jeweiligen Untergruppen untersucht. Diese sind sich in ihren räumlichen Strukturen sehr ähnlich und binden beide dieselben Kofaktoren – Glutathion und ein Eisen-Schwefel-Zentrum. Trotzdem können sie, wie fast alle Mitglieder der Glutaredoxine, entweder nur die eine, oder nur die andere der beiden sehr unterschiedlichen Funktionen ausführen.
In einem aus Greifswald koordinierten Projekt wurde unter Mitarbeit der Düsseldorfer Arbeitsgruppe „Thiology“, gefördert durch die DFG-Schwerpunkte 1710 „Dynamics of Thiol-based Redox Switches in Cellular Physiology“ und 1927 „Iron-Sulfur for life“ wurde nun gezeigt, dass eine aus fünf Aminosäuren bestehende Loop-Struktur nahe des aktiven Zentrums die jeweilige Funktion festlegt. Durch Protein-Engineering, dem 2018 mit dem Nobelpreis für Chemie ausgezeichneten Verfahren zur gezielten Konstruktion von Proteinen mit verbesserten oder veränderten Eigenschaften, wurde gezeigt, dass der Austausch der jeweiligen Loop-Struktur auch zu einem Austausch der Funktionen führt. Die ursprüngliche Oxidoreduktase war nun in der Lage im Modellorganismus Zebrafisch Hämoglobin, den Sauerstofftransporter, zu bilden, verlor aber seine Funktion als Elektronenüberträger und umgekehrt.
Die Aktivitäten der beiden Glutaredoxin-Klassen entstehen dadurch, dass die identifizierten Loop-Strukturen die Wechselwirkung zwischen den Proteinen und ihren Kofaktoren beeinflussen.
Das molekulare Verständnis von Proteinaktivitäten ist eine Voraussetzung für das Verständnis des Lebens. Glutaredoxine, die wichtige Rollen in der Entstehung von zahlreichen neurodegenerativen Krankheiten oder Krebserkrankungen haben, sind zudem potentielle zukünftige medizinische Ansatzpunkte.
Veranstaltungshinweis:
Wer mehr zu Wichtigkeit von Oxidoreduktasen und Elektronenübertragung erfahren möchte, ist herzlich eingeladen zu den Treffen des Netzwerks „redox research rheinland“
Original-Publikation:
Trnka D*., Engelke A.*, Gellert M.*, Moseler A., Hossain M.F., Lindenberg T., Pedroletti L., Odermatt B., de Souza J., Bronowska A., Dick T., Mühlenhoff U., Meyer A., Berndt C., Lillig C.H. (2020), Molecular basis for the distinct functions of redox-active and FeS-transfering glutaredoxins. Nature Communications, DOI: 10.1038/s41467-020-17323-0 PubMed
Kontakt:
PD Dr. Carsten Berndt, Thiology, Klinik für Neurologie, Universitätsklinikum Düsseldorf, Medizinische Fakultät der HHU; Life Science Center, Merowingerplatz. 1a, 40225 Düsseldorf, Tel. 0211/8106041, E-Mail
Quelle: HHU (Copyright 2020)


