Forschungsschwerpunkte
Schwerpunkt Harnblasenkarzinom
PD Dr. Michèle Hoffmann, PD Dr. Günter Niegisch, Prof. Dr. Wolfgang Schulz (Emeritus)
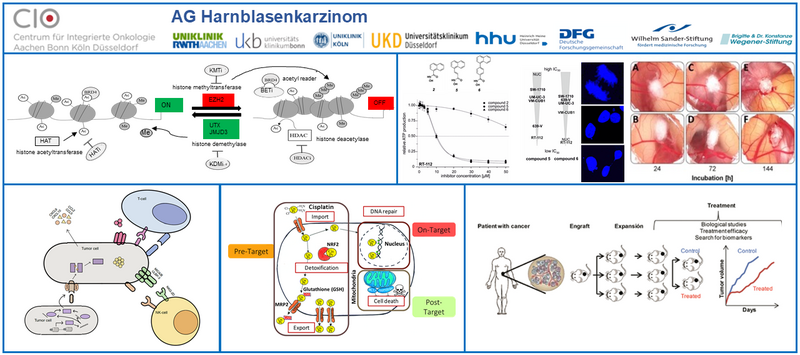
Das Urothelkarzinom (UC) der Harnblase ist die häufigste Form von Blasenkrebs, weltweit die neunthäufigste Tumorart mit 430.000 Neuerkrankungen pro Jahr und 165.000 krebsbedingten Todesfällen. Bei etwa zwei Drittel der Patienten (meist mit nicht-muskelinvasiven UC) lässt sich die Erkrankung durch lokale (transurethrale) Chirurgie, begleitende Behandlungen und engmaschige Folgeuntersuchungen gut kontrollieren; bei einem Drittel der Patienten (meist mit muskelinvasiven UC) verläuft die Erkrankung jedoch aggressiver, so dass die 5-Jahresüberlebensrate trotz radikaler chirurgischer Therapieverfahren bei nur ca. 50% liegt. Da auch durch konventionelle Cisplatin-basierte Chemotherapien bisher keine erhebliche Verbesserung des Langzeitüberlebens erreicht werden konnte, werden dringend neue Therapieoptionen als Alternative oder Ergänzung zur klassischen Chemotherapie für das UC benötigt. Die Erforschung zugrundeliegender molekularer Mechanismen der Therapieresistenz und deren Überwindung durch neue Therapieansätze sind zentrales Ziel der Arbeitsgruppe. mit diesem Ziel verfolgen wir besonders zwei Forschungsrichtungen.
An der Entstehung und Progression des Urothelkarzinoms sind grundlegend epigenetische Veränderungen beteiligt. Tatsächlich weist das UC von allen bisher untersuchten Tumorentitäten sogar die meisten Mutationen in epigenetischen Regulator-Proteinen auf. Sie werden als mit ursächlich für die Veränderungen im Epigenom betrachtet, also in Histonmodifikationen, Chromatinstruktur, DNA-Methylierung, und der Expression langer nicht-kodierender RNAs (lncRNAs). Die genauen Mechanismen, die zur epigenetischen Deregulation führen und ihre möglichen Konsequenzen, wie gestörte Differenzierungsprozesse und gesteigertes Metastasierungspotential, sind jedoch noch zu klären. Schon jetzt jedoch bieten epigenetische Veränderungen Ansatzpunkte für verbesserte Diagnostik und Therapie. Wir analysieren daher zum einen Veränderungen der DNA-Methylierung und der Expression von langen nichtkodierenden RNAs auf ihre Eignung als diagnostische oder prognostische Biomarker. Zum anderen untersuchen wir, inwieweit epigenetische Regulatorproteine als neue therapeutische Angriffsziele genutzt werden können. Da sich Histondeacetylasen (HDACs) in dieser Hinsicht als besonders vielversprechend herausgestellt haben, ist die gründliche Charakterisierung ihrer komplexen Wirkungsweisen ein Ziel der Arbeitsgruppe. Basierend auf den hierbei gewonnenen Erkenntnissen sollen neue epigenetische Therapieansätze für die Monotherapie bzw. Kombination mit konventioneller und moderner zielgerichteter Chemotherapie entwickelt werden.
Epigenetische Mechanismen tragen auch zur Entwicklung von Resistenz gegenüber konventioneller Chemotherapie bei. In einer Reihe von Arbeiten in den letzten Jahren haben wir beobachtet, dass Urothelkarzinomzellen in unterschiedlichem Ausmaß eine Vielfalt von Mechanismen nutzen, um der Wirkung von Cisplatin und anderen Cytostatika zu entgehen. Auf vertieften Analysen dieser Mechanismus heraus wollen wir nunmehr Ansätze entwickeln, um der Entwicklung von Resistenzen gegen diese Medikamente vorzubeugen oder die Tumorzellen wieder zu sensibilisieren.
In unserer Arbeitsgruppe wird ein breites Spektrum an modernen Techniken der Zell- und Molekularbiologie eingesetzt. Wir betreuen Masterarbeiten in den Fächern Biologie, Biochemie und Molekulare Biomedizin und Dissertationen in diesen Fächern und im Fach Humanmedizin.
Schwerpunkt Translationale Uroonkologie
Univ.-Prof. Dr. Daniel Nettersheim
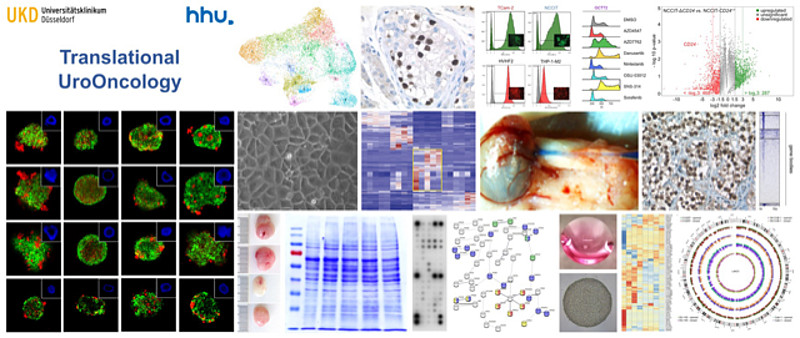
Testikuläre Keimzelltumoren (KZT) stellen die häufigste Tumorerkrankung junger Männer im Alter von 17 - 44 Jahren dar. Trotz sehr guter allgemeiner Heilungschancen, kann die Erkrankung immer noch tödlich verlaufen und zwar wenn eine Resistenz gegenüber der Cisplatin-basierten Standard-Therapie vorliegt. Derzeit haben 30 % der KZT-Patienten ein Rezidiv nach Erstlinien-Chemotherapie und nur 50 % davon können nach Erst- oder Zweitlinien-„Salvage“-Therapie geheilt werden. Die Lebenserwartung Chemotherapie-refraktärer Patienten liegt bei wenigen Monaten. Zudem wird die Cisplatin-basierte Therapie von starken Nebenwirkungen, einer reduzierten Fertilität und dem Risiko einer Zweittumorentwicklung begleitet, was für die jungen Patienten „mitten im Leben“ ein nicht zu unterschätzendes Problem darstellt. Dies zeigt, dass alternative Therapieoptionen für die Cisplatin-resistenten Patienten und zur Standard-Therapie gefunden werden müssen, um die Behandlung der KZTs weiter zu verbessern und um Nebenwirkungen zu reduzieren. Darüber hinaus ist die Pathogenese / Tumorgenese der Keimzelltumoren, also die Gründe und Mechanismen der Tumorentstehung, nicht vollständig verstanden und erforscht.
Schwerpunkt der AG „Translationale Uroonkologie“ ist daher die Erforschung der Keimzelltumor-Entstehung und neuer Therapiemöglichkeiten für Cisplatin-resistente Tumoren.
Ziel ist es neue (epi)genetische, Antikörper-/ Nanobody-basierte Therapeutika in vitro und in vivo zu erforschen und in die klinische Anwendung zu überführen. Des Weiteren sollen die molekularbiologischen und (epi)genetischen Mechanismen der Cisplatin-Resistenz untersucht und verstanden werden. Darüber hinaus erforscht die AG, welchen Einfluss das zelluläre Mikromilieu (Tumor-Stroma) auf die Reprogrammierung und das Zellschicksal der einzelnen Keimzelltumorentitäten nimmt. Es konnte bereits gezeigt werden, dass die Keimzelltumorentwicklung deutlich plastischer ist als bisher angenommen, also unterschiedliche Entitäten ineinander überführt / reprogrammiert werden können. Auch hier werden die molekularen und epigenetischen Mechanismen dieser Plastizität erforscht.
Zur Anwendung kommen moderne Techniken wie das Gen-Editierungsverfahren CRISPR/Cas9 („knock out“- und SAM-System) und Sequenzierungen der nächsten Generation (WG-Seq, (single cell)RNA-Seq, ChIP-Seq, 5mC-Seq) sowie Standardtechniken wie RNAi, qRT-PCR, Western Blot, Immunfluoreszenzfärbungen, FACS-Analysen, ChIP, Co-IP, Dot Blots, Natrium-Bisulfit-Sequenzierung, ELISA-basierte Verfahren und Xenotransplantationen in Nacktmäuse.
Unsere Forschung wurde und wird von folgenden Förderorganisationen unterstützt:
Deutsche Forschungsgemeinschaft (DFG), Deutsche Krebshilfe, CIO ABCD, C. E. Alken-Stiftung, Wilhelm-Sander-Stiftung, Fritz Thyssen-Stiftung, Monika-Kutzner-Stiftung, B. und Dr. K. Wegener-Stiftung, DAAD, BONFOR, Deutsche Gesellschaft für Urologie, Forschungskommission der Med. Fak. der HHU-D, Biomedizinisches Forschungszentrum der HHU-D.
Bewerbungen um Master-Arbeiten und med. Promotionen sind jederzeit möglich und willkommen!
Für mehr Informationen und Publikationen:
Suche nach „Nettersheim Daniel” auf ResearchGate / Figshare / LinkedIn
X: @dannett1980 oder @urooncologyUKD
ORCID: 0000-0002-4483-845X
Die AG ist Teil folgender Fachgesellschaften:



