EGFR

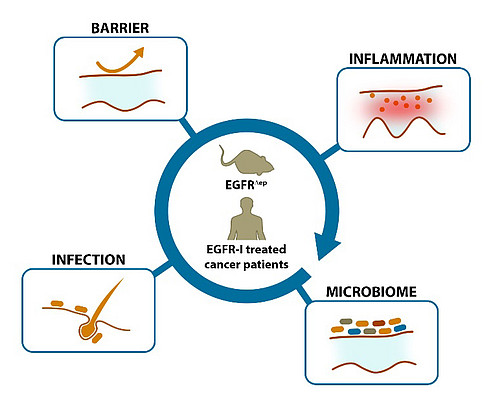
Klassische Krebsbehandlungen, wie Chemo- und Radiotherapien, gehen häufig mit schweren, stigmatisierenden Nebenwirkungen wie kompletten Haarausfall oder dem Verlust der Nägel einher. Leider kommt es auch bei modernen, zielgerichteten Krebstherapien zu Nebenwirkungen, welche die Lebensqualität der Patienten/innen schwer beeinträchtigen und dazu führen können, dass eine erfolgversprechende Therapie abgebrochen wird. Insbesondere Inhibitoren des epidermalen Wachstumsfaktor-Rezeptors (EGFR), die zum Beispiel zur Therapie von Darm- oder Lungenkrebs eingesetzt werden, verursachen in 60-90 Prozent der Fälle schwere, papulopustulöse Hautentzündungen, welche sich im weiteren Verlauf durch bakterielle Sekundärinfektionen verschlimmern können. Die Prävention und Behandlung dieser Entzündung ist bisher nur eingeschränkt möglich und häufig wenig wirksam. Erste Untersuchungen eines Teams von Ärtzten/innen aus Deutschland und eines Teams von Immunologen/innen aus Österreich, zeigen nun erstmals, dass der Bruch der Hautbarriere und kutane Mikrobiota eine Schlüsselrolle bei der Entstehung der Nebenwirkungen spielt. Im aktuellen Forschungsprojekt sollen deshalb, bei mit EGFR-Inhibitoren behandelten Krebspatienten und, parallel dazu, in speziellen genetischen Mausmodellen, die genauen molekularen und mikrobiellen Ursachen der Hautentzündung entschlüsselt werden. Ein durch das Krebsmedikament blockierter Signaltransduktionsweg, die sogenannte MAPK/Erk Kaskade, könnte nach ersten Analysen, den Ausschlag geben, dass die Hautbarriere an den Haarfollikeln durchlässig wird und dadurch Keime eindringen können. Die entstehende Entzündung verursacht im Folgenden dann einen Entzündungsherd, welcher durch pathogene Keime ausgenützt wird und die Hautentzündung drastisch verschlechert.
Die, durch das Projekt gewonnenen Erkenntnisse können anschließend verwendet werden um neue Strategien zur Vorsorge und Management der Nebenwirkungen zu entwickeln. Dadurch wird gehofft, die Lebensqualität der Patienten nachhaltig zu verbessern und die Wirkung der zielgerichteten Krebstherapie zu erhöhen.

Tyrosine kinase inhibitors are, together with immunotherapy, among the most promising approaches for modern efficient cancer therapy. In particular inhibitors for the epidermal growth factor receptor (EGFR-I), which are widely used to treat solid tumors such as colorectal and lung cancer, are associated with a high frequency of stigmatizing cutaneous side effects, including an acneiform rash, dry skin, pruritus, paronychia, alopecia or aberrant hair growth. Importantly, there is a direct correlation between cancer therapy response and rash severity, indicating that the rash severity correlates with EGFR blockade efficiency. It has been established that cutaneous side effects are caused by the direct inhibition of EGFR signaling in the skin.
The majority of human epithelial cancers show an overexpression and/or functional activation of the EGFR, thereby promoting proliferation, anti-apoptosis, angiogenesis, and metastasis. EGFR was selected as one of the first candidates for the development of targeted cancer drugs and up to date various EGFR-inhibitors (EGFR-I) have successfully been established for the treatment of cancer, including non-small cell lung, colorectal, and head-and-neck cancer. Whereas EGFR-I therapy is effective, its feasibility is limited by characteristic side effects that affect patients` quality of life (QoL) and bear a severe threat for therapy adherence. Of note, the pre¬dominance of cutaneous side effects reflects the central function of the EGFR for the skin. Characteristic papulopustular rashes are the most frequent adverse effect of EGFR-I and develop in 60-90% of the patients.
A team of dermatologist, led by Dr. Gerber from Germany and a team of immunologists, led by Dr. Bauer from Austria could recently clarify the events induced by EGFR-I in the skin. The hallmarks of the epidermal inflammation could be identified as a barrier disruption at the hair follicle followed by a bacterial invasion. The current project now aims to clarify the mechanisms behind the breakdown of the skin barrier and the anti-microbial defense, identify the responsible microorganisms and characterize in detail the compositional shifts in the skin microbiota.
Understanding the mechanistic details of the events following EGFR inhibition in the skin of cancer patients, will not only significantly advance our knowledge of the central function of EGFR for the skin but may furthermore identify new therapeutic targets for prevention and management of EGFR-I induced adverse effects. This may not only lead to an improved QoL for cancer patients but may eventually enable more aggressive anti-cancer therapy.