AG Piekorz
1986–1992: Studium der Biologie an der Friedrich-Alexander-Universität Erlangen-Nürnberg
1991–1992: Diplomarbeit an der Friedrich-Alexander-Universität Erlangen-Nürnberg (Charakterisierung der Ca2+ - und Calmodulin-Spiegel in primären Hepatozyten und Hepatomazelllinien)
1992-1997: Doktorarbeit (Dr. rer. nat.) an der Friedrich-Alexander-Universität Erlangen-Nürnberg (Terminale Differenzierung myeloischer Leukämiezelllinien durch IL6-Typ-Zytokine)
1997-2000: Postdoc am Dept. of Biochemistry, St. Jude Children’s Research Hospital, Memphis, USA
2000–2002: Research Associate am Howard Hughes Medical Institut, Dept. of Biochemistry, St. Jude Children’s Research Hospital, Memphis, USA
2002–dato: Senior Scientist, Institut für Biochemie und Molekularbiologie II, Medizinische Fakultät, HHU Düsseldorf
Veröffentlichungen: https://pubmed.ncbi.nlm.nih.gov/?term=piekorz+r&sort=date
Forschung
Sirtuine stellen eine Familie NAD+-abhängiger Enzyme dar, die an der Regulation verschiedener zellulärer Prozesse beteiligt sind, darunter Genexpression, Stoffwechsel und Proliferation (Abb. 1A). Unser Labor konzentriert sich auf die biochemische und zellbiologische Charakterisierung der primär in Mitochondrien lokalisierten Sirtuine, i.e., SIRT3, SIRT4 und SIRT5. Im Besonderen untersuchen wir die subzellulären Funktionen von SIRT4 im Rahmen der Regulierung der Mitochondriendynamik, Autophagie und Zellproliferation. SIRT4 ist in seiner Rolle als metabolischer Tumorsuppressor in Mitochondrien gut charakterisiert und verstanden. Eine erhöhte SIRT4-Expression, bedingt z.B. durch genotoxischen Stress im Zellzyklus, hemmt die zentralen Stoffwechselenzyme Pyruvatdehydrogenase (PDH) und Glutamatdehydrogenase (GDH) und reduziert dadurch die ATP-Produktion und Proliferation. Zusätzlich zu seiner mitochondrialen Rolle lokalisiert SIRT4 subzellulär auch außerhalb der Mitochondrien, wo es bisher unklare Funktionen in der intrazellulären Signalübertragung und Proliferationskontrolle einnimmt. In diesem Zusammenhang konnte unsere Gruppe in neueren Arbeiten mehrere zytosolisch lokalisierte Proteine als Interaktions-/Bindungspartner von SIRT4 identifizieren. Interessanterweise bindet SIRT4 an C-RAF/RAF1, einem Mitglied der RAF-Kinasen, mit einer augenscheinlich negativen Auswirkung auf den MAPK-Signalweg (Abb. 1B). Unsere aktuellen Arbeiten haben daher die Charakterisierung der molekularen Grundlage der SIRT4-C-RAF-Interaktion und deren Bedeutung für nachgeschaltete Signalwege und zelluläre Prozesse zum Ziel.
Aktuelle Publikationen unserer Gruppe:
https://pubmed.ncbi.nlm.nih.gov/38499327/
https://pubmed.ncbi.nlm.nih.gov/37803520/
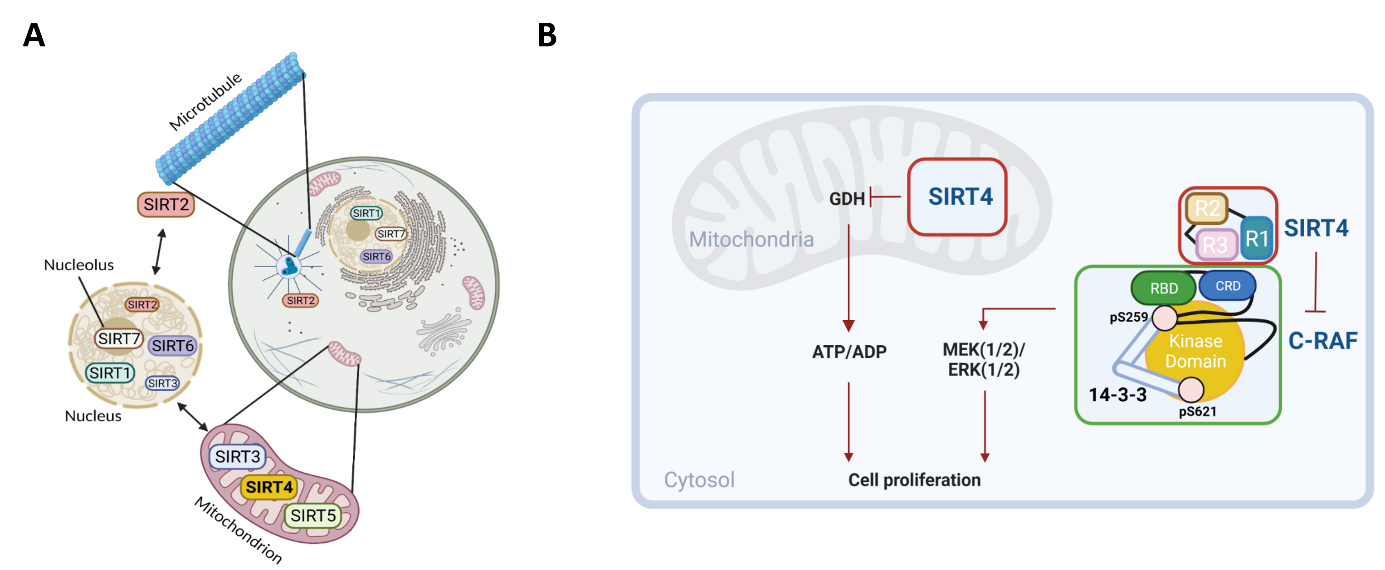
Abb. 1A: Subzelluläre Lokalisation und Funktion humaner Sirtuine. Erstellung der Abb. durch Dr. Laura Bergmann mittels BioRender.
Abb. 1B: Mitochondriale vs. zytosolische Funktionen des Tumorsuppressorproteins SIRT4. Abb. aus Mehrabipour et al., Life Science Alliance, 2024 (https://pubmed.ncbi.nlm.nih.gov/38499327/).


