Fachinformationen über HBO

Herzlich Willkommen auf den Webseiten der Hyperbaren Sauerstofftherapie (HBO) des Universitätsklinikums Düsseldorf
Inhalt dieser Seite (klicken Sie auf das von Ihnen gewünschte Thema)
- Definition der HBO
- Definition der HBO als Therapieform
- Struktur einer HBO-Therapieeinheit ("Tauchfahrt", "Kammerfahrt")
- Ablauf einer HBO-Therapie
- Technische Voraussetzungen und Ausstattung
- Physikalische Grundlagen der HBO
- Physiologie und Biochemie der HBO
- Zusammenfassung - Wirkungen der HBO
Sehr geehrte Frau Kollegin, sehr geehrter Herr Kollege,
HBO ist die gebräuchliche Abkürzung für „Hyperbare Oxygenation“ oder "Sauerstoffüberdruckbehandlung."
Definition der HBO als Therapieform.
Die hyperbare Sauerstofftherapie (HBO) ist definiert als die Atmung von reinem Sauerstoff (100 Vol% oder FiO2 = 1,0) bei einem gegen über der Norm deutlich gesteigerten Umgebungsdruck. Typischerweise erfolgt eine Behandlung mittels HBO in einer Druckkammer. Diese gewährt die Aufrechterhaltung eines gesteigerten Umgebungsdrucks, welcher am gesamten Körper gleichmäßig anliegen muß.
Struktur einer HBO-Therapieeinheit (umgangsprachlich "Kammerfahrt", "Tauchfahrt")
Eine HBO-Therapieeinheit (oder einfach HBO Einheit; HBO E) besteht immer aus 3 Phasen, welche unmittelbar aufeinander abfolgen:
| Phase der HBO-Therapieeinheit | Definition und Beschreibung der Phase |
|---|---|
| Kompression | Hier wird der Umgebungsdruck in der Druckkammer vom normalen Umgebungsdruck (Luftdruck) auf den sogenannten Behandlungsüberdruck gesteigert. Diese Phase ist je nach eingesetztem Therapieschema unterschiedlich lang. Bei schweren und akuten Erkrankungen ist sie eher kurz, bei nicht-akuten nicht-schweren Erkrankungen eher etwas länger. Eine typische Dauer ist 10 Minuten. Die Atmung in der Kompression erfolgt bei den meisten Therapieschemata mit Luft (Pressluft), seltener mit Mischgasen wie Nitrox oder in Ausnahmefällen mit Sauerstoff. |
Isopression | In dieser Phase wird der Behandlungsüberdruck für einen vordefinierten, unterschiedlichen langen Zeitraum aufrechterhalten. In dieser Zeit wird größtenteils 100% Sauerstoff geatment. Bei einigen Therapieschemata werden sogenannten Sauerstoffpausen von 5-10 Minuten Dauer eingelegt. |
Dekompression | In dieser Phase wird der Behandlungsüberdruck auf den normalen Umgebungsdruck (Luftdruck) abgesenkt. Je nach Behandlungsschema erfolgt die Dekompression schrittweise in Phasen oder durchgängig als eine Phase. Entsprechend variiert die Dauer. Die Atmung in der Dekompression ist überwiegend die von 100% Sauerstoff. Sauerstoffpausen kommen bei ausgedehnten Dekompressionsphasen zum Einsatz (selten). |
Jede HBO Therapieeinheit wird nach einem bestimmten Therapieschema durchgeführt. Es gibt unterschiedliche Therapieschemata; diese sind für bestimmte Erkrankungen und Erkrankungsgruppen besser oder schlechterm geeignet und werden entsprechend angewendet. Überlappungen sind möglich.
Ablauf einer HBO-Therapie
In den allermeisten Fällen ist eine HBO-Therapie eine Behandlungsserie mit mehr als 1 Therapieeinheit über einen bestimmten Zeitraum. In Abhängigkeit von der zu behandelnden Erkrankung variiert die Anzahl der Therapieeinheiten: bei Kohlenmonoxidvergiftungen leichterer Natur kann eine Einheit zureichend sein, bei schwersten therapierefraktären chronischen Wundheilungsstörungen können auch 60 Therapieeinheiten erforderlich sein.
Technische Voraussetzungen und Ausstattung
Die Druckkammer, in der eine HBO-Therapie durchgeführt wird, existiert in zwei wesentlichen Typen: als 1-Personendruckkammer (ggf. auch 1 zusätzlicher Begleiter) oder als Mehrpersonendruckkammer (mindestens 2 Plätze für Patienten).
In einer 1-Personendruckkammer wird die Atmung von Sauerstoff insbesondere in den U.S.A. durch Füllung der gesamten Kammer mit Sauerstoff bewerkstelligt. Alternativ ist auch eine Maskenatmung möglich. In einer Mehrpersonendruckkammer erfolgt die Atmung von 100% Sauerstoff grundsätzlich über ein Atmungssystem mit Maske. Sofern erforderlich, kann das Atmungssystem auch direkt an einen Beatmungstubus bzw. an eine Trachealkanule angeschlossen werden.
Die HBO des Universitätklinikums Düsseldorf verfügt über eine 12-Personendruckkammer. In dieser wird die Atmung von 100% Sauerstoff über ein Atmungsystem mit Masken realisiert.
Physikalische Grundlagen:
Die Wirkungen der HBO-Therapie sind durch umfangreiche experimentelle Studien gut definiert und lassen sich auf physikalische, physiologische und biochemische Grundprinzipien zurückführen.
Die hyperbare Sauerstofftherapie verwendet als physikalisches Hilfsmittel einen erhöhten Umgebungsdruck, der bei einigen Indikationen, z.B. bei Tauchunfällen oder Gasembolien, auch als eigenständige therapeutische Komponente wirkt.
Die wichtigsten Auswirkungen des erhöhten Umgebungsdrucks lassen sich mit drei physikalischen Gesetzen beschreiben:
| Boyle-Mariotte Gesetz | Druck und Volumen eines (idealen) Gases verhalten sich bei konstanter Temperatur zueinander umgekehrt proportional. |
|---|
Bei der Applikation von Überdruck kommt es zu einer mechanischen Kompression gasgefüllter Hohlräume. Nach Robert Boyle (25.01.1627-30.12.1691) und Edme Mariotte (1620-12.05.1684) ist dabei das Produkt aus Druck und Volumen bei abgeschlossenen Gasräumen und gegebener Temperatur konstant. Wird z.B. der Druck einer bestimmten Gasmenge auf das Doppelte gesteigert, so halbiert sich das Gasvolumen.
Betroffen sind hiervon sowohl anatomisch vorgegebene gasgefüllte Hohlräume (z.B. Nasennebenhöhlen, Lunge etc.), als auch Gasblasen gleich welcher Genese im Körpergewebe bzw. im Gefäßsystem.
Nachfolgend eine graphische Veranschaulichung dieser Zusammenhänge:
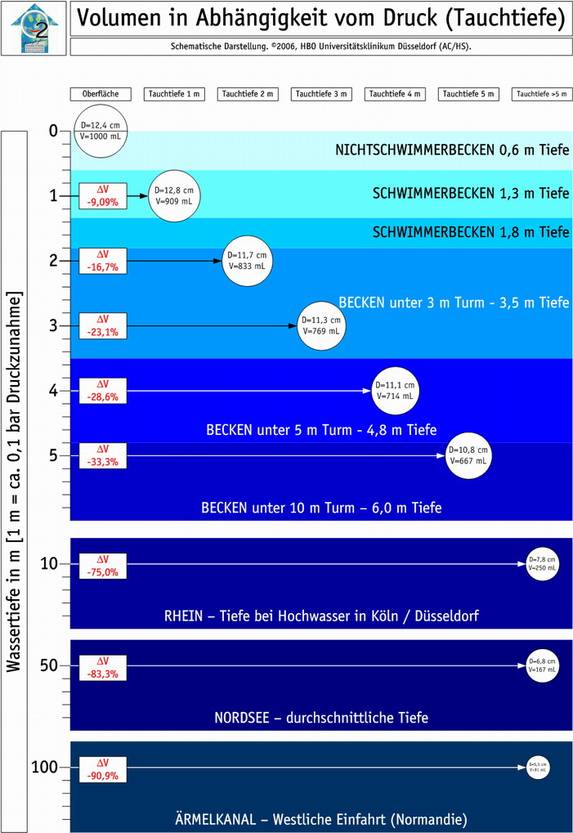
Dieses Gesetz erklärt die Verkleinerung des Volumens von Gasblasen nach arterieller Gasembolie oder Dekompressionskrankheit während einer Rekompression.
| Dalton-Gesetz | Bei (idealen) Gasen ist die Summe aller Teildrücke p-teil gleich dem Gesamtdruck des Gasgemischesp-gesamt. |
|---|
Als weiterer Effekt der Erhöhung des Umgebungsdruckes kommt es zu einer analogen Teildruckerhöhung der Atemgase. Nach John Dalton (06.09.1766-27.07.1844) setzt sich der Gesamtdruck eines Gasgemisches (z.B. Luft) aus den Partialdrucken seiner Gaskomponenten zusammen.
Dies hat zur Folge, daß schon bei Luftatmung unter hyperbaren Bedingungen der Sauerstoffteildruck, der sog. pO2 , in der Inspirationsluft steigt. Bei Atmung von 100% Sauerstoff als Inspirationsgas steigt der pO2 entsprechend proportional zur Gesamtdruckerhöhung an und entspricht in diesem Fall dem einwirkenden Umgebungsdruck.
Diese Zusammenhänge werden durch die nachfolgenden Abbilundungen nochmals verdeutlicht.
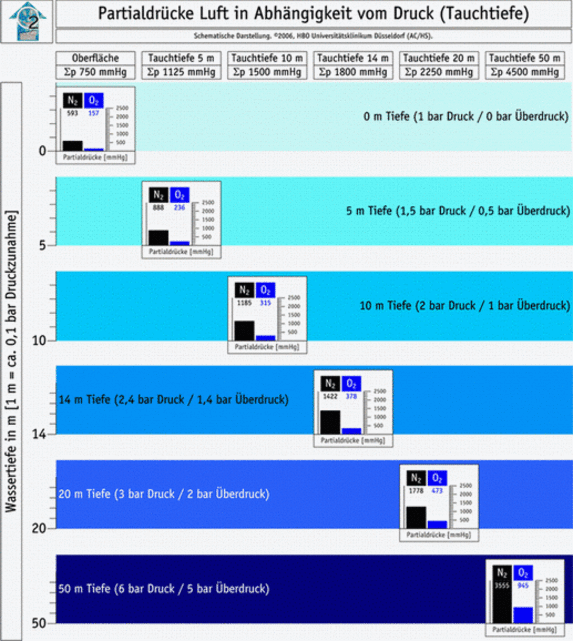
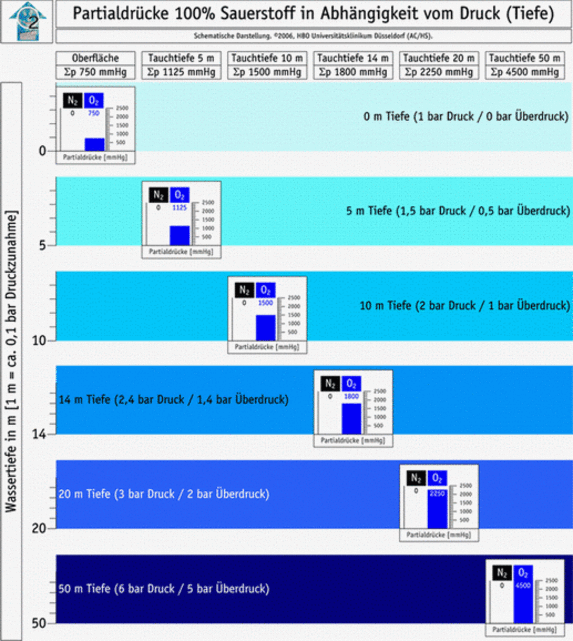
Wie ersichtlich ist, nimmt der Partialdruck sowohl von Stickstoff (ca. 79 Vol% der Luft) als auch von Sauerstoff (ca. 21 Vol% der Luft) mit steigendem Druck zu. Verwendet man statt Luft reinen Sauerstoff (100 Vol%), so steigt der Partialdruck des Sauerstoffs entsprechend seinem Anteil (100%) deutlich stärker mit zunehmenden Druck. Entsprechend dem Gesetz von Dalton ist der Partialdruck des Sauerstoffs (pO2) somit de facto gleich dem Umgebungsdruck.
| Henry-Gesetz | Der Teildruck einer Substanz (Gas) in einer Flüssigkeit oder Lösung ist gleich dem Produkt aus Löslichkeit des Gases und dem (Umgebungs-)Druck |
|---|
William Henry (12.12.1775-02.09.1836) beschreibt die Lösung von Gasen in Flüssigkeiten in Abhängigkeit vom einwirkenden Außendruck, wobei mit ansteigendem Umgebungsdruck entsprechend mehr Gas in Flüssigkeiten, wie z.B. dem Blut oder der Gewebsflüssigkeit, gelöst wird.
Daraus folgt, daß bei einer Anhebung des Sauerstoffpartialdruckes im Atemgas proportional auch die im Blut physikalisch gelöste Sauerstoffmenge steigt.
Die Transportkapazität der Erythrozyten ist allerdings begrenzt. Bei Gesunden ist das Hämoglobin im arteriellen Schenkel unter Normaldruckbedingungen zu 96 - 98% mit Sauerstoff gesättigt. Eine signifikante Steigerung der Sauerstoffaufnahme des Körpers ist über die chemische Bindung an das Hämoglobin nicht zu erreichen.
Bei der Sauerstoffatmung unter Überdruck wird das Hämoglobin als Transportmedium umgangen und der Sauerstoff vermehrt physikalisch im Blut gelöst.
Der Amsterdamer Chirurg Boerema veröffentlichte 1961 sein berühmtes Werk „Life without blood“. Er entfernte bei Versuchstieren die Erythrozyten als Sauerstoffträger und füllte das Volumen mit Plasmaexpander auf. Es zeigte sich, daß die Tiere trotz des erythrozytenfreien Blutes unter hyperbaren Bedingungen einzig und allein aufgrund des physikalisch gelösten Sauerstoffanteils überlebten.
Physiologische und biochemische Mechanismen der HBO:
Sauerstoff-Diffusionsstreckenverlängerung:
Die Sauerstoffversorgung der Gewebe erfolgt hauptsächlich über Diffusion aus den Kapillargefäßen. Die Diffusionsstrecke für Sauerstoff wird wesentlich durch seinen Teildruckgradienten von der Kapillare zum Gewebe mitbestimmt. Je höher der Partialdruckgradient und je größer der physikalisch gelöste Sauerstoffanteil im Blut, desto besser können weiter von der Kapillare entfernt liegende Gewebebereiche erreicht und oxygeniert werden.
Im Zylindermodell der kleinsten Blutgefäße (Kapillare) des dänischen Physiologen August Krogh läßt sich dieser Zusammenhang wie folgt deutlich machen:
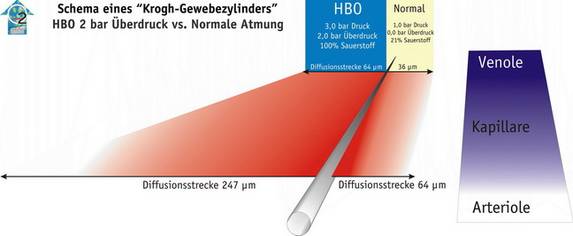
Unter hyperbaren Bedingungen kann sich die Sauerstoffdiffusionsstrecke vervierfachen, d.h. der Sauerstoff erreicht Körperzellen, deren Versorgung, z.B. bei Verletzungen oder Durchblutungsstörungen, bedroht ist.
Ödemreduktion:
Bei einer Ödembildung steigt der Gewebedruck und die Sauerstoffdiffusionsstrecke wird negativ beeinflusst. Als Folge der Reduktion des Blutflusses kommt es zu einer Ischämie, die zur Gewebshypoxie und letztendlich zu einem Zelluntergang führen kann.
Das vermehrte Sauerstoffangebot unter HBO-Bedingungen wird vom Organismus als eine Luxusversorgung angesehen, auf die im normalen Gewebe eine reaktive Vasokonstriktion folgt. Unter hyperbaren Bedingungen hat diese für die Sauerstoffversorgung aufgrund des erhöhten Sauerstoffpartialdruckes keinen Nachteil.
Während der HBO kommt es bei der Vasokonstriktion zu einer Verringerung des hydrostatischen Druckes in den Kapillaren, wodurch das kapillare Filtrationsgleichgewicht verändert wird. Die Folge hiervon ist die Resorption von interstitieller Flüssigkeit, d.h. es kommt zu einer Ödemreduktion.
Die oben beschriebene Vasokonstriktion findet in hypoxischem Gewebe nicht statt. Dies bedeutet, dass eine Blutumverteilung in die mangelversorgten Areale als sog. „inverser steal-effect“ auftritt und sich dadurch dort die Versorgungssituation verbessert.
HBO-Einfluss auf die Wundheilung:
Unter normalen Bedingungen stellt die durch die Verletzung hervorgerufene Hypoxie in der Wunde einen Trigger für die Auslösung von Reparationsvorgängen dar. Überschreitet die Hypoxie jedoch einen kritischen Wert, kann eine physiologische Wundheilung nur eingeschränkt oder gar nicht stattfinden.
Die HBO ist in der Lage, gestörte Wundheilungsvorgänge auf vielfältige Weise zu verbessern:
Die Neoangiogenese wird durch die HBO indirekt angeregt, so daß die Blut- und Sauerstoffversorgung problematischer Wundgebiete auch langfristig verbessert werden kann.
Diese Gefäßneubildung geht vom gut oxygenierten Wundrand mit niedrigen Laktatwerten aus. Die Gefäßaussprossung erfolgt entlang den Gradienten in Richtung auf das hypoxische, mit hohen Laktatwerten belastete Wundgebiet.
Obwohl einige Angioneogenesefaktoren besondern durch eine niedrige Sauerstoffspannung getriggert werden, findet die stärkste Antwort auf diesen Proliferationsreiz jedoch in den hyperoxischen Venolen des Wundrandes statt.
Die Proliferation der Fibroblasten und deren Kollagensynthese sind sauerstoffabhängig. Die Menge Kollagen in einer heilenden Wunde sowie ihre Vernetzungsrate korrelieren in gewissen physiologischen Bereichen direkt mit dem Gewebs-pO2 . Im hypoxischen Gewebe sind die Funktionen der Prolin-Hydroxylase zum Aufbau von Kollagenmolekülen sowie der Lysin-Hydroxylase zur Quervernetzung der Kollagenketten untereinander eingeschränkt bzw. aufgehoben. Dieser Mangelzustand kann durch die HBO dosisabhängig kompensiert werden.
Leukozyten und Makrophagen benötigen im Rahmen der Infektabwehr und der Wundheilung große Mengen Sauerstoff. Bei einem Sauerstoffmangel ist ihre Funktion beeinträchtigt und die Abwehrleistung vermindert, als Folge können sich Wunden infizieren.
Die HBO-Therapie kann die Leistung dieser Zellen und damit auch ihre Abwehrfunktionen verbessern, sodaß die physiologischen Wundheilungsvorgänge wieder in Gang gesetzt werden.
Die HBO-Therapie wirkt auf mehreren Wegen gegen Krankheitskeime. So können z.B. Anaerobier in einer sauerstoffreichen Umgebung nicht überleben und werden daher während der HBO-Therapie direkt abgetötet. Aufgrund dessen kann für einen Gasbrandpatienten die HBO-Behandlung lebensrettend sein.
Darüber hinaus wird bei Mischinfektionen die Wirkung einiger Antibiotika bei der Infektabwehr unter hyperoxischen Bedingungen synergistisch verstärkt.
Knochenheilung:
Sowohl bei akuten als auch bei chronischen Knochenerkrankungen (Osteitis, Osteomyelitis, Osteoradionekrose) handelt es sich immer um schlecht durchblutetes Knochengewebe mit hierdurch bedingter mangelhafter Infektabwehr. Sowohl die Osteoklasten als auch die Osteoblasten benötigen für ihre Funktion ausreichend Sauerstoff.
Die HBO ermöglicht daher bei hypoxiebedingten Problemen im Bereich des Knochengewebes sowohl einen vermehrten Abbau nekrotischen Materials durch eine verstärkte Osteoklastentätigkeit als auch einen Knochenneuaufbau durch eine sauerstoffinduzierte Osteoblastenaktivierung.
Auch bei freien Knochentransplantaten findet eine Beschleunigung der Einheilungsvorgänge und Umbauprozesse statt.
Kohlenmonoxidvergiftung:
Kohlenmonoxid hat eine im Vergleich zu Sauerstoff vielfach höhere Bindungsaffinität zum Hämoglobin, so daß es den Sauerstoff kompetitiv verdrängt. Die Folge ist eine Blockierung des Hämoglobins für den Sauerstofftransport zu den Zellen, dadurch kommt es zu intrazellulären Schäden durch Unterbrechung der Atmungskette.
Primäres Ziel der HBO-Behandlung ist die schnelle Sauerstoffversorgung der Gewebe durch die Erhöhung des physikalisch gelösten Blutsauerstoffanteils unter Umgehung des Hämoglobins als Sauerstoffträger. Durch Erhöhung des Sauerstoffangebotes wird das Kohlenmonoxid über denselben kompetitiven Mechanismus von den Sauerstoffbindungsstellen verdrängt, zudem kann das Kohlenmonoxid durch die HBO mehr als zehnmal schneller aus dem Körperkreislauf eliminiert werden.
Tauchunfall / Dekompressionserkrankung:
Bei Tauchunfällen sowie bei Gasembolien werden Gasblasen im Gewebe oder in der Blutbahn sowohl durch den Überdruck als auch durch die Sauerstoffanreicherung verkleinert und schneller eliminiert. Der erhöhte Sauerstoffpartialdruck sorgt für eine schnelle und effiziente Sauerstoffversorgung der durch die Gasblase verlegten und dadurch mangelversorgten Gebiete.
Um direkten Blaseneffekten, wie mechanische Gewebezerreißungen, Gewebekompressionen und Gefäßverschlüssen zu begegnen, ist eine Sauerstoffbehandlung unter Überdruck sinnvoll.
Zusammenfassend ergeben sich folgende
Effekte der Hyperbaren Sauerstofftherapie:
- Verlängerung der Diffusionsstrecke für Sauerstoff, d.h. es werden weiter von der Kapillare entfernt liegende Gewebsbereiche erreicht und oxygeniert
- antiödematöse Vasokonstriktion ohne die Folge einer ischämischen Hypoxie
- Angioneogenese (indirekt)
- Aktivierung der Fibroblastenproliferation und der Kollagensynthese
- Aktivierung von Leukozyten und Makrophagen
- Bakterizidie gegenüber anaeroben Erregern und Inaktivierung ihrer Toxine
- Osteoklastenaktivierung und Osteoneogenese
- kompetitive Verdrängung von Kohlenmonoxid vom Hämoglobin und damit schnellere Elimination
- Verkleinerung von Gasblasen nach Dekompressionserkrankung oder Gasembolie


