Behandlungsresistente Nierenzellkarzinome als Modellsystem
Dies gilt auch für das Nierenzellkarzinom: Das Nierenzellkarzinom zeichnet sich durch eine weitgehende Resistenz gegenüber einer Apoptose-Induktion durch Zytostatika, Bestrahlung und immun-therapeutischer Konzepte aus und hat deshalb nach erfolgter Metastasierung eine äußerst schlechte Prognose. Ursächlich beteiligt an dieser ausgeprägten Therapieresistenz des Nierenzellkarzinoms ist eine Defizienz der CD95- und TRAIL-vermittelten Apoptose. Die molekularen Mechanismen dieser Resistenz gegenüber einer Todesrezeptor-vermittelten Apoptose im Nierenzellkarzinom sind bislang unklar, könnten aber in spezifischen Störungen der jeweiligen Signaltransduktionskaskade begründet sein wie etwa in der Überexpression von Survivin und XIAP. Am Modellsystem permanenter Nierenkarzinomzellinien unterschiedlicher histologischer Typen wird deshalb versucht, zu einem besseren Verständnis der Apoptoseresistenz des Nierenzellkarzinoms zu kommen. Hieraus könnten sich in Zukunft Parameter zur besseren Abschätzung der Tumoraggressivität sowie Ansätze zur Entwicklung neuer therapeutischer Konzepte ableiten lassen.
Gezieltes Drug Development als Chance zur Überwindung der Therapieresistenz von Nierenzellkarzinomen und anderen Tumoren
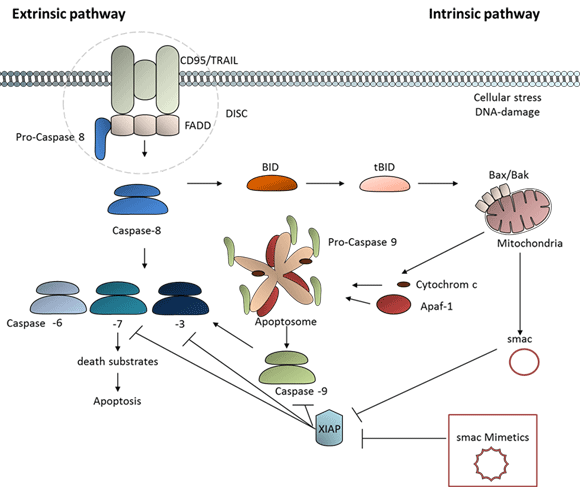
Die spezifische Induktion von Zelltodmechanismen zur Überwindung der Therapieresistenz von Tumoren hat eine große Bedeutung. Die Inhibitor of Apoptosis Proteins (IAPs), die an apoptotischen Signalkaskaden beteiligt sind und in Tumoren vermehrt vorliegen, spielen bei der Resistenzentstehung eine wichtige Rolle. Die Wechselwirkung zwischen den IAPs und ihren zellulären Zielstrukturen den Caspasen-3, -7 oder -9 führt zur Inaktivierung und damit zur Hemmung der Apoptose-Maschinerie. Als natürlicher Gegenspieler der IAPs wirkt das Second Mitochondria-derived Activator of Caspases (SMAC), indem es die IAPs bindet und somit die (Re-)Aktivierung der Caspasen ermöglicht. Hierfür entwickelten und charakterisierten wir drei neue Substanzen – LBPS01, LBPS03 und LBPS05 – die als neuartige Smac-Mimetika das Potential besitzen XIAP zu inhibieren und Tumor-spezifisch den Zelltod per se zu induzieren. Die zugrunde liegenden Mechanismen sind bislang nicht charakterisiert und werden zurzeit in einem laufenden Projekt bearbeitet. Aus Tumor-immunologischer Sicht sind leukämische Zelllinien besonders zur Untersuchung der Wirkungsweise von Smac-Mimetika geeignet, weil sie nach ursprünglicher Apoptose-relevanter Eingruppierung in Typ-II-Zellen (definiert über die CD95-Ligand Wirkung) den mitochondrialen Apoptoseweg verstärkt aktivieren und Proteinkomplexe wie bspw. den Apoptosomen- und PIDDosomen-Komplex bilden und somit geeignete Zellen für diese neuen Möglichkeiten therapeutischer Intervention darstellen.
Die erfolgreiche Bearbeitung dieses Forschungsfeldes wird zum besseren Verständnis der Resistenzentwicklung in soliden Tumoren und leukämischen Zellen beitragen und dadurch einen neuen Ansatz zur Definition neuer therapeutischer Optionen ermöglichen.