Forschungsgebiete und Projekte AG Esposito (for English scroll down)
Die Neoplasien des pankreatobiliären Systems gehören zu den aggressivsten malignen Tumoren des Menschen. Die Mehrzahl der Patienten befindet sich zum Zeitpunkt der Diagnose in einem fortgeschrittenen Stadium der Erkrankung und die 5-Jahres-Überlebensrate liegt bei lediglich 12-13 %. In unserer Arbeitsgruppe werden zum einen die ersten Phasen der Tumorentstehung und Progression erforscht, mit Hauptaugenmerk auf der Rolle der Regeneration und der Entzündung in der Karzinogenese. Dabei stehen die Interaktion zwischen Stromazellen und epithelialen Zellen und die molekulare Charakterisierung der Vorläuferläsionen im Vordergrund. Zum anderen beschäftigen wir uns mit der genetischen Basis der Tumorheterogenität und der molekularen Subtypisierung von pankreatobiliären Karzinomen sowie mit der Etablierung neuer zielgerichteter Therapieansätze.
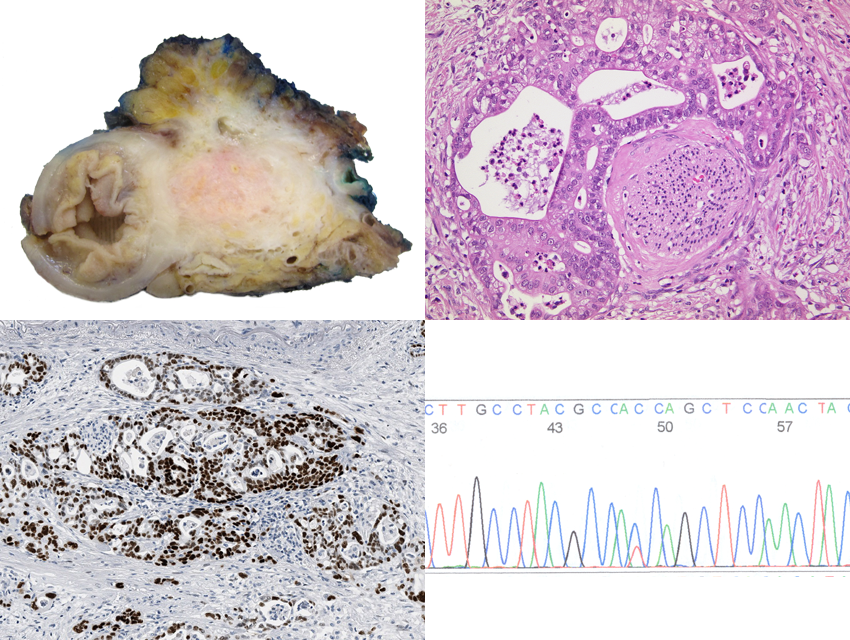
Pankreasregeneration und Karzinogenese
Regenerative Prozesse im Pankreas können die Grundlage für chronische Veränderungen bilden und zur Tumorentstehung beitragen. Nach einer Schädigung des Organs wird ein Teil der azinären Zellen, die Verdauungsenzyme produzieren, zerstört, während die verbleibenden Zellen einen spezifischen Regenerationsmechanismus durchlaufen. Diese Zellen zeigen eine hohe Plastizität und werden in einen progenitorähnlichen Zustand überführt, in dem sie proliferative Eigenschaften annehmen, um das geschädigte Gewebe zu ersetzen. Die Regeneration geht mit einer fibrotischen Reaktion einher, die durch die Aktivierung stromaler Zellen – insbesondere pankreatischer Sternzellen – ausgelöst wird, welche Bestandteile der extrazellulären Matrix (ECM) sezernieren. Im regenerativen Zustand sind azinäre Zellen besonders anfällig für onkogene Reize; so fördert die Expression des mutierten KRAS-Gens maßgeblich die Bildung von Vorläuferläsionen und die Progression zum duktalen Adenokarzinom des Pankreas (PDAC). Ein charakteristisches Merkmal der Karzinomentwicklung ist die begleitende Fibrose, bei der eine ausgeprägte Desmoplasie einen Großteil der Tumormasse ausmachen kann. Ziel unserer Forschung ist es, die funktionelle Rolle der Fibrose sowie die Zusammensetzung der ECM im Kontext von Regeneration und Tumorentwicklung mithilfe transgener Mausmodelle systematisch zu untersuchen.
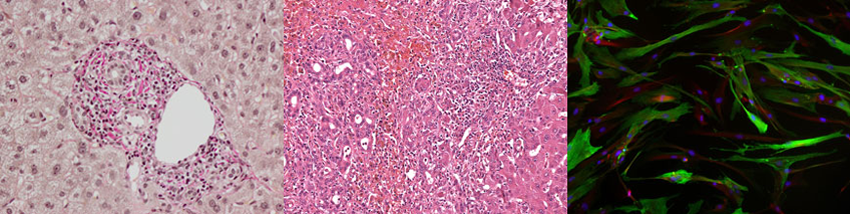
Molekulare Charakterisierung und Subtypisierung von Adenokarzinomen des pankreatobiliären Systems und deren Vorläufer
Vorläuferläsionen des PDAC umfassen neben den pankreatischen intraepithelialen Neoplasien (PanIN) auch intraduktale papilläre muzinöse Neoplasien (IPMN), muzinöse zystische Neoplasien (MCN) sowie atypische flache Läsionen (AFL). Mit Ausnahme der AFL wurden vergleichbare Läsionen auch im Gallengangssystem identifiziert. Die genetischen Grundlagen dieser Läsionen sowie deren potenzieller Zusammenhang mit unterschiedlichen Subtypen invasiver Karzinome sind bislang unzureichend verstanden. Da präventive Maßnahmen derzeit nicht verfügbar sind, stellen die frühzeitige Detektion präinvasiver Läsionen sowie die Identifikation von Hochrisikogruppen zentrale Herausforderungen dar. Durch den Einsatz von Next-Generation-Sequencing (NGS) analysieren wir umfassend Mutations- und Expressionsprofile aus Patientenproben mit und ohne Tumorentwicklung. Diese Daten werden funktionell sowie retrospektiv und prospektiv validiert, um tumorbiologische Zusammenhänge aufzuklären und Risikoprofile zu entwickeln. Ein weiterer Fokus liegt auf der Standardisierung morphologischer Kriterien zur Identifikation früher Läsionen, einschließlich der Azinus-zu-Duktus-Metaplasie (ADM), einem kritischen Schritt in der neoplastischen Transformation.
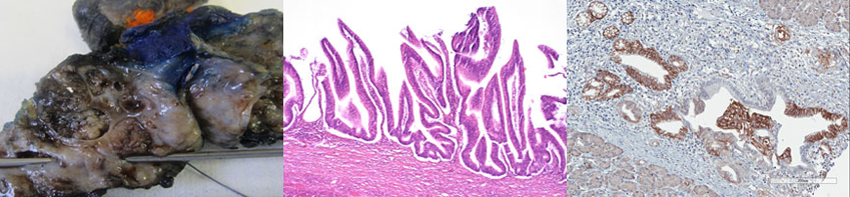
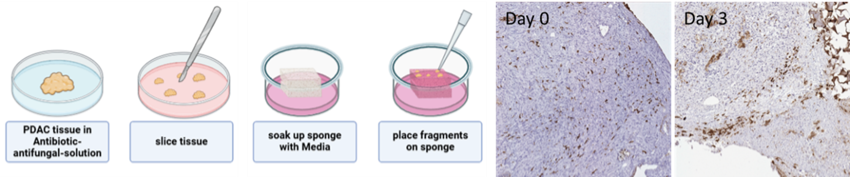
Ex-vivo-Modell des duktalen Adenokarzinoms des Pankreas
Das duktale Adenokarzinom des Pankreas (PDAC) ist eine äußerst aggressive Krebserkrankung mit schlechter Prognose, hauptsächlich aufgrund später Diagnose, eingeschränkter chirurgischer Therapiemöglichkeiten und früher Metastasierung. Trotz intensiver Forschung bleiben die Überlebensraten niedrig. Um das Verständnis der PDAC-Biologie und des Tumormikromilieus (TME) zu verbessern, haben wir ex-vivo-Modelle aus humanen und murinen Tumorfragmenten etabliert. Diese Modelle bewahren die native Gewebearchitektur sowie zelluläre und mikroumgebungsbedingte Interaktionen. Zur Charakterisierung verwenden wir Histologie, Immunhistochemie, Multiplex-Bildgebung und Genexpressionsanalysen mit dem Ziel, die translationale Relevanz dieser Modelle für die Biomarkerforschung und therapeutische Testungen zu erhöhen.
Research Areas and Projects of the working group of Prof. Esposito (English version)
Neoplasms of the pancreatobiliary system are among the most aggressive malignant tumors in humans. The majority of patients are diagnosed at an advanced stage of the disease, with a 5-year survival rate of only 12-13 %. In our research group, we investigate the early phases of tumor initiation and progression, with a primary focus on the role of regeneration and inflammation in carcinogenesis. Central to this is the interaction between stromal cells and epithelial cells, as well as the molecular characterization of precursor lesions. Additionally, we study the genetic basis of tumor heterogeneity and the molecular subtyping of pancreatobiliary carcinomas, along with the development of new targeted therapeutic approaches.
Pancreatic Regeneration and Carcinogenesis
In the pancreas, regenerative events can form the basis for chronic changes and also contribute to tumor development. Upon injury to the organ, a portion of the digestive enzyme-producing acinar cells is destroyed, while the remaining acinar cells undergo a specific regeneration mechanism. These acinar cells exhibit high plasticity and are transformed into a progenitor-like state, in which they adopt proliferative properties to replace damaged tissue. The regeneration process is accompanied by a fibrotic response, driven by activation of stromal cells – particularly pancreatic stellate cells – which secret extracellular matrix (ECM) components. In the regenerative state, acinar cells are highly susceptible to oncogenic stimuli, such that the expression of the mutated KRAS gene strongly drives the formation of precursor lesions and progression to pancreatic ductal adenocarcinoma (PDAC). A characteristic feature of carcinoma development is the accompanying fibrosis, where pronounced desmoplasia can constitute the majority of the tumor mass. Our research investigates the functional relevance of fibrosis and its composition of various extracellular matrix proteins in pancreatic regeneration and tumor progression, utilizing advanced transgenic mouse models.
Molecular Characterization and Subtyping of Adenocarcinomas of the Pancreatobiliary System and Their Precursors
Precursor lesions of PDAC include pancreatic intraepithelial neoplasias (PanIN), intraductal papillary mucinous neoplasms (IPMN), mucinous cystic neoplasms (MCN), and atypical flat lesions (AFL), with most – except AFL – also identified in the biliary tract. The molecular mechanisms underlying their development, and whether distinct lesions give rise to different carcinoma subtypes, remain unclear. As prevention is not currently viable, early detection and risk strafitication are critical. Using next-generation sequencing (NGS), we generate comprehensive mutational and expression profilies from both cancerous and non-cancerous patient-derived lesions. These data are functionally validated in retrospective and prospective cohorts to elucidate tumorgenic pathways and assess predictive value. Addtionally, we are developing standardized criteria for the histopathological assessement of early precursor lesions, including acinar-to-ductal metaplasia (ADM), a pivotal step in neoplastic transformation.
Ex Vivo Model of Pancreatic Ductal Adenocarcinoma
Pancreatic ductal adenocarcinoma (PDAC) is a highly lethal malignancy, primarily due to late-stage diagnosis, limited surgical options, and rapid metastasis. Despite extensive research efforts, survival rates remain low. To advance understanding of PDAC biology and its tumor microenvironment (TME), we established ex vivo models using patient-derived and murine tumor fragments. These models preserve native tissue architecture and cell-microenvironmental interactions. We characterize them using histology, immunohistochemistry, multiplex imaging and gene expression analysis, with the goal of enhancing their translational relevance for biomarker discovery and therapeutic testing.


