Die gastroenteropankreatischen neuroendokrinen Tumoren (GEP-NET), die auch unter den Begriffen „Karzinoid“ und „Inselzelltumor“ bekannt sind, gehen von den neuroendokrinen Zellen des GEP-Systems aus. Dieses Zellsystem und seine Tumoren sind durch die Expression zelltypspezifischer Peptidhormone und genereller Marker wie Synaptophysin und Chromogranin-A charakterisiert. Alle GEP-NET sind einer gemeinsamen Klassifikationen unterworfen. Die Inzidenz dieser Tumoren, die mit 1-2/100.000/Jahr angegeben wird, scheint anzusteigen, was wahrscheinlich vor allem auf eine verbesserte und intensivere endoskopische Diagnostik zurückzuführen ist.
Klinisches Erscheinungsbild und Leitsymptome
Die Symptomatik der Patienten mit GEP-NET hängt von der hormonellen Aktivität der Tumoren und von der Lokalisation und Tumorausdehnung ab.
Rezidivierende Hypoglykämien sind typisch für Insulinome. Sie äußern sich in adrenergen Symptomen wie Tachykardie, Angst, Schwitzen und Palpitationen und schließlich bei ausbleibender Kohlenhydratzufuhr in dem neuroglykopenischen Symptom des Bewusstseinsverlustes.
Rezidivierende duodenale Ulzerationen und ein gastroösophagialer Reflux sind die Leitsymptome duodenaler oder pankreatischer Gastrinome. Selten treten nur Diarrhoen auf.
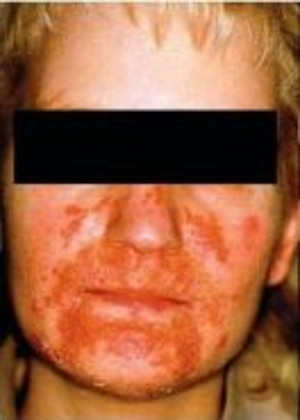
Ein nekrolytisch-migratorisches Erythem, ein ausgeprägter Gewichtsverlust und eine Glukoseintroleranz kennzeichnen das Glukagonom. Ein VIPom führt zu wässrigen Durchfällen, die eine Dehydratation zur Folge haben.
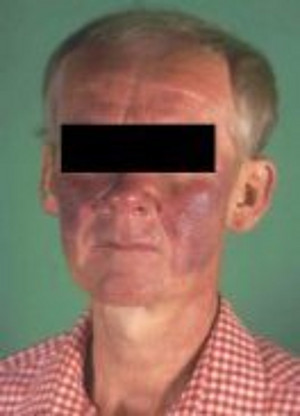
Diarrhoen, Bauchkrämpfe und typischer Flush, insbesondere in der Gesichts-, Hals und Thoraxregion, sind Symptome von metastasierten ilealen NET. In der Regel beginnt der Flush plötzlich und dauert initial nur Sekunden bis wenige Minuten, häufig begleitet von brennenden Missempfindungen der Haut und Hitzegefühl. 40 bis 50% aller Patienten mit Karzinoid-Syndrom entwickeln auch eine kardiale Manifestation in Form einer plaqueartigen Fibrose der Trikuspidalklappen und der Pulmonalklappen.
| Tumortyp | Leitsymptome | Tumortyp | Leitsymptome |
Gastrinom
| Magen- und Zwölfinger-darmgeschwüre, Bauchschmerzen, wässrige Durchfälle | Insulinom
| Neuroglukopenie (mangelnde Energieversorgung des Gehirns durch Zucker-[Glucose-]Mangel) |
Glukagonom-Syndrom
| Hautausschlag (wanderndes migratorisches Erythem), Zuckerkrankheit (Diabetes mellitus) | Karzinoid-Syndrom
| Anfallsartige Gesichts-rötung (Flush) mit Herzklopfen und Schweißausbrüchen, krampfartige Bauchschmerzen, Durchfälle, Atembeschwerden |
| VIPom | Wässrige, massive (bis zu 8 l) Durchfälle, Schwäche, Muskelkrämpfe | Somatostatinom-Syndrom | Gallensteine, Diabetes mellitus, Bauchschmerzen, breiige Durchfälle |
Quelle: Novartis GmbH
Einteilung
Entsprechend einer alten Klassifikation aus dem Jahre 1963 wurden die GEP-NET nach embryogenetischen Gesichtspunkten in „foregut“- (Lunge, Magen, Duodenum, oberes Jejunum und Pankreas), „midgut“- (unteres Jejunum, Ileum, Appendix, Zökum), und „hindgut“-Karzinoide (Kolon und Rektum) unterteilt. Diese Klassifikation wird jedoch der unterschiedlichen Biologie und Hormonproduktion aller heutzutage bekannten Tumorentitäten nicht gerecht. Die WHO unterscheidet primär zwischen dem gut differenzierten neuroendokrinen Tumor mit benignem oder fraglich benignem Verhalten vom gut differenzierten neuroendokrinen niedrigmalignen Karzinom und dem schlecht differenzierten neuroendokrinen hochmalignen Karzinom. Dabei entspricht das „Karzinoid“ alter Terminologie dem gut differenzierten neuroendokrinen Tumor / Karzinom. Sekundär werden die GEP-NET nach Lokalisation und klinisch-pathologischen Kriterien (Metastasierung, Tumorinvasion, Tumorgröße etc.) differenziert. Diese Klassifikation wird ergänzt durch eine TNM-Klassifikation und ein Grading-System.
Labordiagnostik
Bei Verdacht auf ein serotoninproduzierenden NET des Ileum („Ileumkarzinoid“) wegen rezidivierter Durchfälle und einer Flushsymptomatik muß die 5-Hydroxy-Indolessigsäure, ein Abbauprodukt des Serotonins, im angesäuerten 24-Stunden-Urin bestimmt werden. Falsch positive Werte können durch verschiedene Nahrungsmittel (z.B. Bananen) bedingt sein.
Zum Nachweis eines Gastrinoms bei rezidivierten Ulzera muss der Gastrinwert im Serum bestimmt werden. Die Kombination eines Nüchterngastrinwertes von >1000 pg/ml zusammen mit einem intragastralen pH-Wert von < 2,5 ist praktisch beweisend für diese Erkrankung. Hohe Gastrinwerte finden sich allerdings auch bei Patienten mit chronisch-atrophischer Gastritis. Liegt die Gastrinkonzentration bei Hyperazidität zwischen 150 und 1000 pg/ml, muss die Diagnose durch einen Sekretin-Test und durch die Bestimmung der basalen Magensäure-Sekretion bestätigt werden. Nüchtern-Gastrin-Werte zwischen 150 und 1000 pg/ml finden sich auch unter einer Protonenpumpenhemmer-Therapie.
Bei spontanen Hypoglykämien und Verdacht auf ein Insulinom ist ein standartisierter Hungerversuch unter stationären Bedingungen angezeigt. Ein Abfall der Plasmaglukose unter 40 mg/dl bei zugleich nicht supprimierten Insulin- und C-Peptid-Werten spricht für ein Insulinom. Allerdings sollten zusätzlich die Sufonylharnstoffspiegel im Blut oder Urin bestimmt werden, um eine artifiziell herbeigeführte Hypoglykämie auszuschließen. Für die laborchemische Diagnose einer sogenannten Nesidioblastose des Erwachsenen mit inadäquater Insulinsekretion wird neben einem Hungertest bzw. C-Peptid-Suppressionstest ein intraarterieller Calciumstimulationstest (ASVS) zur Regionalisierung einer pathologischen Insulinsekretion durchgeführt.
Bei Glukagonomen als Ursache eines nekrotisierenden Exanthems mit Diabetes mellitus findet man Serumglukagonspiegel von >50 pmol/l. Bei wässrigen Durchfällen und Verdacht auf ein VIPom liegen meist im Nüchternzustand VIP-Serumspiegel von mehr als 200 pg/ml vor.
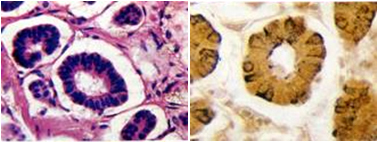
Chromogranin A ist ein sehr sensitiver, jedoch relativ unspezifischer Serummarker für GEP-NET. Falsch hohe Werte finden sich z.B. bei einer Niereninsuffizienz oder einem ausgeprägtem Malabsorptionssyndrom. Nützlich ist die Chromogranin A-Bestimmung zur Verlaufsbeurteilung, da deren Serumspiegel mit der Tumormasse korreliert.
Bildgebende Diagnostik
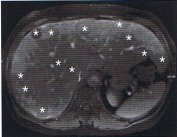
Tumorlokalisation und Tumorausbreitung sind entscheidend für die Therapieplanung. Die Wertigkeit der verschiedenen diagnostischen Verfahren hängt stark von Typ und Lokalisation des Primärtumors ab. Prinzipiell gilt, dass kein Verfahren allein ausreichend sensitiv ist. Es wird daher ein multimodales diagnostisches Konzept empfohlen, welches CT- und MRT-Diagnostik mit nuklearmedizinischer Untersuchung kombiniert. Trotzdem bleibt bei 20 – 50% der GEP-NET die Primärlokalisation unbekannt.
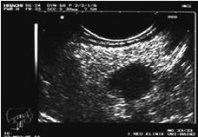
Standard in der Schnittbilddiagnostik ist die CT, die den Primärtumor in 22 – 45% der Fälle lokalisiert. Die CT-Diagnostik von Gastrinomen oder Insulinomen hängt maßgeblich von der Größe des Tumors ab, wobei Tumoren unter 1 cm Größe nur selten entdeckt werden. Für die Lokalisation von Insulinomen und Gastrinomen wird daher die Endosonographie empfohlen, die in der Hand eines erfahrenen Untersuchers als das sensitivste Detektionsverfahren angesehen wird (Sensitivität für duodenale NET 45 – 60%; für pankreatische NET 90 – 100%). Lebermetastasen zeigen in der CT häufig eine ausgeprägte Hypervaskularisation (Sensitivität >80%), die Sensitivität der Kernspintomographie ist noch etwas höher.
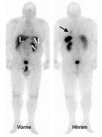
Einen weiteren Eckpfeiler für die Lokalisationsdiagnostik stellt die Somatostatinrezeptor-szintigraphie (Octreotid-Szintigraphie) dar. Die Nuklearmedizin bietet derzeit verschiedene Tracer an, die sich bezüglich der Eigenschaften der Rezeptorliganden und der Markierungsnuklide unterscheiden. Mit dem 111In-markierten Octreotid liegen langjährige Erfahrungen vor. Die positive Darstellung der Tumoren ist eine unabdingbare Voraussetzung für die Indikationsstellung zur Therapie mit radioaktiven Somatostatinrezeptoranaloga.
Chirurgische Therapie
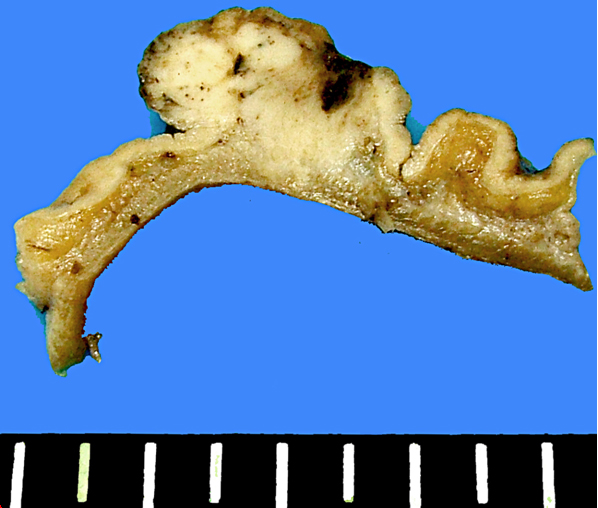
Die Chirurgie der GEP–NET folgt onkologischen Resektionsprinzipien. Auf Grund der Seltenheit dieser Tumoren gibt es jedoch keine evidenzbasierten chirurgischen Therapieempfehlungen sondern nur Experten-Empfehlungen. Die Indikation zur Primärtumorchirurgie sind klinische Symptome, Tumorgröße und Lokalisation, Malignität und potentielle metastatische Ausbreitung. Angestrebt wird generell ein lokal radikales Vorgehen bei gleichzeitigem maximalem Funktionserhalt insbesondere für pankreatische NET.
Bei den NET des Magens vom Typ 1 und 2 (<2cm; keine Angioinvasion; Tumorausdehnung begrenzt auf die Mukosa-Submukosa) reichen endoskopische Abtragungen mit jährlichen Kontrollen. Der Typ 3 (> 1cm) wird je nach Lokalisation durch eine subtotale Magenresektion oder Gastrektomie therapiert und der Typ 4 wird analog dem Adenokarzinom des Magens reseziert.
Bei NET des Dünndarms wird eine Resektion der tumortragenden Dünndarmschlingen unter Mitnahme der Lymphabflusswege, und bei NET des Kolon eine Standardkolonresektion einschließlich einer Lymphknotendissektion empfohlen.
Bei den duodeno-pankreatischen NET steht die operative Radikalität dem Organerhalt zur Vermeidung einer exokrinen und endokrinen Insuffizienz gegenüber. Für die häufigeren, sporadischen NET des Pankreas, die meist solitär vorkommen, empfiehlt sich die organerhaltende Resektion, wobei das Spektrum von einer Tumorenukleation, Pankreasschwanz- oder zentralen Pankreassegmentresektion mit zwischengeschalteter Dünndarmschlinge bis zur pyloruserhaltenden Pankreaskopfresektion oder multiviszeralen Resektion reicht. Als „first-line“ Therapie sollte die chirurgische Metastasenresektion das Ziel einer vollständigen Entfernung (R0) haben. Allerdings sind auch Re-Operationen mit palliativem Charakter gerechtfertigt.
Die Chirurgie der Lebermetastasen erfordert eine Expertise auf diesem Gebiet. Die angewandten Verfahren reichen von atypischen offenen oder laparoskopischen bis hin zu erweiterten Resektionen. Bei unzureichend verbleibendem gesundem Lebergewebe, ist eine mehrzeitige Vorgehensweise mittels portal-venöser Embolisation (PVE) mit anschließender Resektion angezeigt.Die Indikation zur Lebertransplantation besteht in speziellen Fällen.
Bei hereditären MEN1 – assoziierten GEP-NET ist ein individuelles chirurgisches Vorgehen notwendig. Diese NET treten generell multipel auf. Zudem führen die duodenalen NET frühzeitig zu Lymphknotenmetastasen und haben daher eine hohe Rezidivrate. Die operative Strategie bei MEN1-assoziierten pankreatischen NET reicht von der Enukleation mit Organerhalt, aber damit erhöhtem Rezidivrisiko bis zur radikalen Resektion mit nachfolgender exokriner und endokriner Insuffizienz. Dies bleibt oft eine intraoperative Entscheidung. Bei den MEN1-assoziierten multiplen duodenalen Gastrinomen mit ihrer frühzeitigen Lymphknotenmetastasierung empfiehlt sich eine früh-aggressive radikale Chirurgie.
Die sehr seltene Insulinomatose und die adulte Nesidioblastose bedürfen auf Grund einer diffusen Verteilung der neoplastischen oder hypertrophierten insulinproduzierenden Zellen einer differenzierten chirurgischen Therapie. Die Schwierigkeit liegt im Ausmaß der Resektion zur adäquaten Reduktion der Betazellmasse, um so einer Krankheitspersistenz, einem Rezidiv oder einer endokrinen Insuffizienz vorzubeugen.
Chemoembolisation und Radiofrequenzablation
Die transarterielle Chemoembolisation (TACE) der Leber ist ein Palliativverfahren, welches nur bei nicht resektablen, disseminiert verteilten Lebermetastasen indiziert ist. Es gibt keine Vergleichsstudien, die eine Überlegenheit der Chemoembolisation gegenüber alternativen, systemischen Therapien belegen. Verwendete Chemotherapeutika sind Doxorubicin, Cisplatin, Streptozocin, Mitomycin und Fluoruracil. Diese können mit iodiertem Öl (Lipiodol) zu einer Suspension vermischt, und oder mit Embolisationspartikeln kombiniert werden. Neuerdings sind Embolisationspartikel verfügbar, an die Doxorubicin gebunden ist (Ansprechraten 40-80%, therapiebedingte Letalität 0-6%). Die mittlere Progressionzeit beträgt ca. 15 Monate. Als unerwünschte Nebenwirkungen der Therapie treten regelhaft ein Postembolisationssydrom auf. Bei fehlerhafter Indikationsstellung und Durchführung drohen allerdings lebensgefährliche Komplikationen. Das Risiko einer Karzinoid-Krise und eines Leberabszesses wird durch periinterventionelle Hormon- oder Antibiotikatherapie deutlich gesenkt.
Die Radiofrequenzablation (RFA) stellt ein weiteres Palliativverfahren dar. Da es bei disseminierter Metastasierung jedoch kaum möglich ist, jede Metastase mit der RFA-Sonde aufzusuchen, wird die Radiofrequenzablation in Kombination mit anderen Verfahren, meist einer Leberresektion, eingesetzt.
Nuklearmedizinische Therapie
Wenn eine kurative chirurgische Therapiemaßnahme nicht möglich ist, stehen u.a. nuklearmedizinische Verfahren zur Verfügung. Diese richten sich insbesondere nach der Ausdehnung des Tumors, dem Proliferationsindex Ki-67 und der möglichen hormonellen Aktivität. Im Falle von langsam wachsenden GEP-NET mit hoher Octreotid-Speicherung sollte eine DOTATOC- bzw. eine DOTATATE-Therapie in Erwägung gezogen werden. Die Indikation hierfür ist der Nachweis eines Tumorprogresses innerhalb von 3 Monaten unter einer anderen etablierten Therapie (zumeist Somatostatinanaloga). Partielle Tumorregressionen werden in ~30%, Tumorstabilisierungen in mehr als 50% der Fälle gesehen. Die mediane Zeit bis zur erneuten Progression der Erkrankung liegt für die DOTATOC-Therapie bei 30-40 Monaten.
Medikamentöse Therapie
Somatostatinanaloga werden häufig als Langzeit-Präparate mit monatlich intramuskulären Injektionen verabreicht. In einer Placebo-kontrollierten Doppelblindstudie wurde die tumorproliferationshemmende Wirkung von Somatostatinanaloga belegt. Die Medikamente sind jedoch nur für hormonaktive GEP-NET zugelassen. Das neuere, ebenfalls sehr effektive Somatostatinanalogon SOM 230 (Parsireotid) bindet insbesondere an den Somatostatinrezeptor-Sybtyp 5. Das Medikament ist jedoch noch nicht allgemein verfügbar. Eine kombinierte Therapie eines Somatostatinanalogons mit Interferon alpha ist weniger sinnvoll. Neue Therapieverfahren, wie z. B. mit dem mTOR-Inhibitor RAD001 und Zelltherapien sind derzeit in Erprobung.
Für die Therapie von metastasierten pankreatischen NET ist auch bei niedrigerem Proliferationsindex häufig die Indikation für eine Streptozotocin-haltige Chemotherapie gegeben. Partielle Remissionen werden in 20-35% der Fälle gesehen.
Bei Tumoren des Mitteldarms mit erhöhter proliferativer Aktivität wird eine Kombinationschemotherapie bestehend aus Cisplatin und Etoposid empfohlen. Unter dieser Therapie kann es allerdings zu hormonellen Krisen kommen. Bei niedrigproliferativen Tumoren ist diese Therapie wirkungslos.
Prognose
Erfolgt, für alle GEP-NET zusammengenommen, die Diagnose vor dem Auftreten von Metastasen, so liegt die 10-Jahre-Überlebensrate (JÜR) über 90%; mit Metastasen geht die JÜR gegen 50%. Dies Verhalten ist weitgehend unabhängig vom Primärtumor, zeigt jedoch eine Abhängigkeit vom Proliferationsindex (< 5% 10-JÜR bei 80%; > 10% 10-JÜR bei 20%).
Wenn Sie sich umfangreicher zu diesem Thema informieren möchten, verwenden Sie bitte den nachfolgenden Link.