Forschungsschwerpunkte
Die Arbeitsgruppe Schmitt untersucht die Pathomechanismen kardiovaskulärer Erkrankungen. Im Mittelpunkt unseres Forschungsinteresses stehen die kontraktilen Einheiten der Herzmuskelzellen, die Sarkomere. Sie vermitteln durch das Kalzium-abhängige Zusammenspiel der Myosinköpfchen mit den dünnen Filamenten Kontraktion und Relaxation der Zellen und bestimmen damit die Pumpleistung des Herzens.
Mit Hilfe von biochemischen Methoden, Fluoreszenzmikroskopie, kultivierten Zellen und Krankheitsmodellen in vivo arbeiten wir an folgenden Fragestellungen:
1. Wodurch sind die Störungen der Sarkomerfunktion in der Akutphase des Herzinfarkts verursacht?
Beim Herzinfarkt ist ein umschriebener Teil des Herzmuskels von der Durchblutung abgeschnitten (Ischämie), mit der Folge, dass das betroffene Gewebe abstirbt. Kontraktion und Relaxation sind jedoch auch in den nicht-ischämischen Anteilen des Herzmuskels beeinträchtigt. Da diese Areale für den Verlust des infarzierten Gewebes kompensieren müssen, versuchen wir die molekularen Ursachen für ihre Funktionsstörung zu klären. Unser Ziel ist es, durch eine frühe Gegenregulation die Pumpleistung des Herzens zu verbessern, um die hohe Sterblichkeit in den ersten Tagen nach einem Herzinfarkt zu senken. Dafür untersuchen wir die Funktion der Sarkomerproteine sowie deren Kalzium-abhängige Aktivierung in nicht-diabetischen und diabetischen Herzen. Bei Diabetikern ist die Frühletalität nach Herzinfarkt nämlich besonders hoch.
2. Wie hängen Funktion und Morphologie des Herzens zusammen?
In diesem Projekt untersuchen wir Gendefekte in den Sarkomeren, die angeborene Herzmuskelerkrankungen verursachen, sogenannte familiäre Kardiomyopathien. Folge dieser Gendefekte sind Störungen von Kontraktion und/oder Relaxation, aber auch ein vermehrtes Wachstum des Herzmuskels sowie die Einlagerung von Bindegewebe. Trotz medikamentöser Therapie nehmen familiäre Kardiomyopathien fast immer einen progredienten Verlauf und führen häufig zu Herzmuskelschwäche und/oder lebensgefährlichen Herzrhythmusstörungen. In mindestens 40% aller Fälle verursachen die Erkrankung Gendefekte im Myosin. Wir versuchen die molekularen Zusammenhänge zwischen diesen Myosin-Mutationen und den Veränderungen von Funktion und Morphologie des Herzmuskels besser zu verstehen, um langfristig neue Therapiemöglichkeiten entwickeln zu können.
3. Welchen Einfluss haben Veränderungen im Kalzium-Haushalt der Herzmuskelzellen auf deren Kontraktion und Relaxation?
Störungen im Kalzium-Haushalt der Herzmuskelzellen können Schlüsselsignale darstellen für die Ausprägung funktioneller und struktureller Herzerkrankungen. Um die Zusammenhänge besser zu verstehen, analysieren wir die Folgen von Störungen in Proteinen, die den zellulären Kalzium-Haushalt regulieren. Mit dem gewonnenen Wissen testen wir das therapeutische Potential gezielter Eingriffe in die Kalzium-Regulation bei Herzerkrankungen. Bisherige Untersuchungen haben gezeigt, dass eine Punktmutation in einem Regulatorprotein des intrazellulären Kalziumtransports, dem Phospholamban, bereits vor dem 30. Lebensjahr schwere Veränderungen des Herzmuskels verursacht, die binnen weniger Jahre zum vollständigen Organversagen führen. Ursache ist eine verlangsamte Kalzium-Elimination aus den Sarkomeren. Die Erhöhung der Geschwindigkeit und der Regulierbarkeit des Phospholamban-abhängigen Kalzium-Transports können den Krankheitsverlauf abschwächen.
Kalzium-abhängige Regulation der Sarkomerfunktion
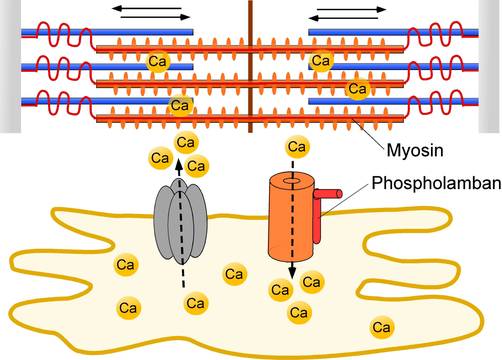
Vor der Kontraktion jeder Herzmuskelzelle wird Kalzium aus intrazellulären Speichern (unten) freigesetzt und vermittelt in den Sarkomeren (oben) eine Längenverkürzung. Danach leitet der aktive Rücktransport des Kalziums die Muskelrelaxation ein.
Veränderungen im Sarkomer oder in Kalzium-Transportproteinen können strukturelle und funktionelle Herzerkrankungen verursachen.
Publikationen
PubMed
Autorenschaften





