
Der Funktionsbereich Endokrinologie des Endokrinen Tumorzentrums arbeitet an der Charakterisierung einer induzierten Immunantwort bei neuroendokrinen Karzinomen. Ziel ist es, ein Immuntherapiekonzept auf der Basis von autologen dendritischen Zellen für endokrine Karzinome - insbesondere des medullären Schilddrüsenkarzinoms - zu entwickeln. Im Mittelpunkt der Forschung stehen dendritische Zellen, die als hochpotente Antigen-präsentierende Zellen in der Lage sind, das Immunsystem zu modulieren und eine zytotoxische Immunantwort zu induzieren
In verschiedenen in vitro und in vivo Studien konnte gezeigt werden, dass diese Zellen bei endokrinen Karzinomen eine Th1-Immunantwort induzieren können. Weiterhin konnte erstmals nachgewiesen werden, dass das Polypeptidhormon Calcitonin als Zielantigen für eine Tumorimmuntherapie eingesetzt werden kann. Dies ist in sofern von Bedeutung, als das Tumorantigene für endokrine Karzinome bisher nicht identifiziert wurden. Vergleichbare Resultate wurden ebenfalls für das Parathormon beim Nebenschilddrüsenkarzinom erzielt.
Für die Etablierung eines neuen Immuntherapiekonzeptes finden derzeit Studien in Form eines transgenen Tiermodells statt. Die Bemühungen der Arbeitsgruppe und die ersten Ergebnisse wurden im März 2007 mit dem Merck European Thyroid Von Basedow Research Prize 2007 von der Deutschen Gesellschaft für Endokrinologie ausgezeichnet.
Auf der Basis dieser Ergebnisse und einer vorhandenen GMP-Anlage (Good Manufacturing Practice) soll zukünftig ein verbessertes Immuntherapiekonzept für Patienten mit endokrinen Karzinomen angeboten werden. Die derzeit laufenden Studien werden unter anderem von der American Thyroid Association, der Deutschen Forschungsgemeinschaft und der Sander-Stiftung unterstützt.

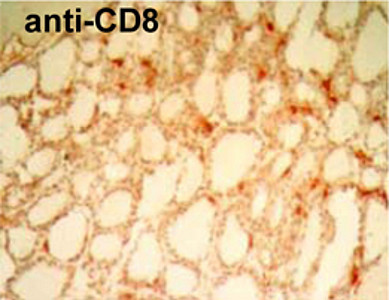
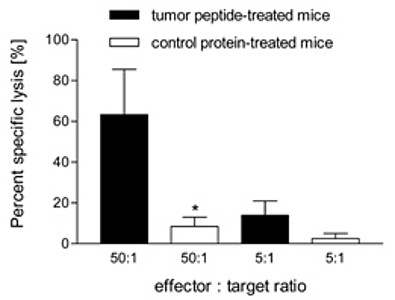
In einer 2008 publizierten Studie (Clinical Cancer Research 2008) konnte in einem transgenen Tiermodell für das medulläre Schilddrüsenkarzinom erstmals gezeigt werden, dass eine Immunisierung mit einem Aminosäure-veränderten Polypeptidhormon zu einer Antigen-spezifischen Immunreaktion führt. Die Antigen-spezifischen zytotoxischen T-Zellen (CD8+) infiltrieren die Tumore, wohingegen Kontrollprotein-immunisierte Mäuse keine Infiltration zeigen. Weiterhin konnte gezeigt werden, dass die zytotoxischen T-Zellen medulläre Schilddrüsenkarzinom-Zellen in vitro abtöten können. Die therapierten Mäuse zeigen um etwa 75% kleiner Tumore sowie deutlich erniedrigte Tumormarker. Bei einigen der therapierten Mäuse war kein Tumor mehr nachweisbar.

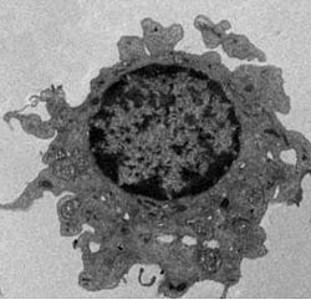
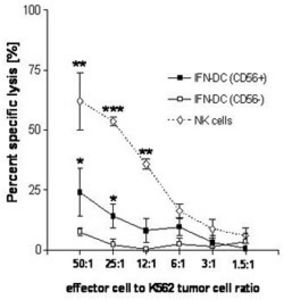
In dem Wissenschaftsjournal The Journal of Immunology zur Publikation angenommenen Manuskript konnte unsere Arbeitsgruppe erstmals zeigen, dass Monozyten nach Kultivierung mit Interferon-alpha zu hochpotenten dendritischen Zellen mit NK-Zell-Charakter ausreifen. Phänotypisch konnte dies mit dem Nachweis des Oberflächenmarkers CD56 und der intrazellulären Expression von TRAIL gezeigt werden. Diese Zellen weisen eine hohe Antigen-exprimierende und erstaunlicherweise direkte zytotoxische Aktivität auf. Diese Arbeit ist von hoher Relevanz, da sie das bisherige immunologische Konzept einer funktionellen und phänotypischen Diversität von DCs und NK-Zellen in Frage stellt.
Anti-Tumor Immunität, Tumor-Escape Mechanismen und Interventionsstrategien
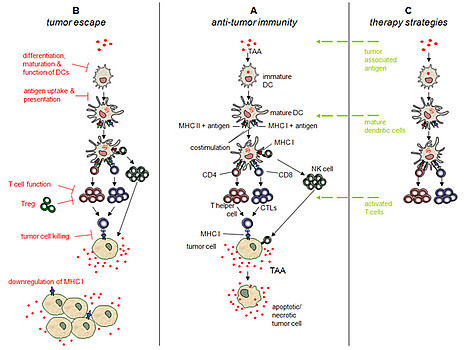
Schematische Darstellung der Anti-Tumor Immunität, von Tumor-Escape Mechanismen und von möglichen immunologischen Interventionsstrategien. Eine entscheidende Rolle in der Antitumorimmunität (A) spielen die dendritischen Zellen, die über eine breite Immunantwort mit Induktion von T-Helfer-Zellen und zytotoxischen T-Zellen eine direkte Tumorzelllyse vermitteln können. In einem cross-talk zwischen dendritischen Zellen und NK-Zellen sind auch diese in der Lage, Tumorzellen zu zerstören. Mögliche Tumor-Escape Mechanismen (B) sind z.B. eine unzureichende Ausreifung der dendritischen Zellen, eine fehlerhafte T-Zell-Funktion, eine Herunterregulierung von MHC Klasse I-Molekülen auf Tumorzellen und viele andere. Unsere Arbeitsgruppe beschäftigt sich mit der Identifizierung von Tumorantigenen als auch verschiedenen immunologischen Interventionsstrategien wie z.B. der Vakzinierung mit Antigen-exprimierenden dendritischen Zellen als auch dem adoptiven T-Zell-Transfer (C).
Ausgewählte Publikationen der Arbeitsgruppe Schott am Endokrinen Tumorzentrum
- Erlic Z, Hoffmann MM, Peczkowska M, Harsch I, Schott M, Gabbert, Valimäki M, Preuss SF, Hasse-Lazar K, Waligorski D, Franke G, Robledo M, Januszewicz A, Eng C und Neumann HPH: Pathogenicity of DNA variants and double mutations in multiple endocrine neoplasia type 2 and von Hippel-Lindau syndrome.J Clin Endocrinol Metab 2010, 95(1):308-13
- Raffel A, Eisenberger CF, Cupisti K, Baldus SE, Topp SA, Schulte am Esch J, Peiper J, Schott M, Knoefel WT und Stoecklein NK: Increased EpCAM expression in malignant insulinoma: potential clinical implication. Eur J Endocrinol. 2010, 162(2):391-8
- Lehwald N, Cupisti K, Willenberg HS, Schott M, Krausch M, Raffel A, Wolf A, Brinkmann K, Eisenberger CF und Knoefel WT: Standard-radical vs. function-preserving surgery of benign nodular goiter - a sonographic and biochemical 10 years-follow-up study. Langenbecks Arch Surg 2009, 394(2): 279-83
- Erlic Z, Rybicki L, Peczkowska M, Hohenberg W, Kann PH, Dralle H, Müssig K, Muresan M, Schäffler A, Reisch N, Schott M, Fassnacht M, Opocher G, Klose S, Fottner C, Forrer F, Plöckinger U, Peterssen S, Zabolotny D, Januszwicz A, Walz M, Eng C, und Neumann HPH for the European-American Pheochromocytoma Study Group: Clinical Predictors and Algorithm for the Genetic Diagnosis of Pheochromocytoma Patients.Clin Cancer Res 2009, 15(20):6378-85
- Papewalis C, Wuttke M, Jacobs B, Willenberg HS, Schinner S, Scherbaum WA und Schott M: Role of the novel mTOR inhibitor RAD001 (Everolimus) in anaplastic thyroid carcinoma. Horm Metab Res 2009, 41(10):752-6
- Papewalis C, Wuttke M, Schinner S, Willenberg HS, Scherbaum WA und Schott M: NVP-BEZ235, a Dual PI3K/mTOR Inhibitor, Prevents PI3K Signaling and Inhibits the Growth of Thyroid Tumor Cells. Horm Metab Res 2009,41(5):397-401
- Lachenmayer A, Lichtenauer UD, Cox T, Schott M, Malendowicz LK, Goretzki PE, Cupisti C, Scherbaum WA, Bornstein SR und Willenberg HS: Nestin as a valuable marker in the classification of adrenocortical tumors. Horm Metab Res 2009 Horm Metab Res. 2009, 41(5):397-401
- Broecker-Preuss M, Sheu SY, Worm K, Feldkamp J, Witte J, Scherbaum WA, Mann K, Schmid KW und Schott M: Expression and mutation analysis of the tyrosine kinase c-kit in poorly differentiated and anaplastic thyroid carcinoma and its possible clinical implication. Horm Metab Res 2008, 40: 685-691
- Wuttke M, Papewalis C, Meier Y, Kessler C, Jacobs B, Willenberg HS, Kouatchoua C, Seissler J, Baehring T, Scherbaum WA und Schott M: Amino acid-modified calcitonin immunization induces tumor epitope-specific immunity in a transgenic mouse model for medullary thyroid carcinoma. Endocrinology 2008, 149: 5627-5634
- Jacobs B, Wuttke M, Papewalis C, Willenberg HS und Schott M: Dendritic cell subtypes and in vitro generation of DCs. Horm Metab Res 2008, 40:99-107
- Jacobs B, Papewalis C, Wuttke M, Fenk R, Ullrich E, Willenberg HS, Schinner S, Seissler J und Schott M: Characterization of monocyte-derived IFNalpha-generated dendritic cells. Horm Metab Res 2008, 40:117-21
- Papewalis C, Wuttke M, Meyer Y, Kessler C, Jacobs B, Seissler J, Ullrich E, Willenberg HS, Schinner S, Scherbaum WA und Schott M: Dendritic cell vaccination with xenogenic polypeptide hormone induces tumor rejection in neuroendocrine cancer. Clin Canc Res 2008, 14: 4298-305
- Jacobs B, Papewalis C, Willenberg HS, Schinner S, Cohnen M, Seissler J, Scherbaum WA und Schott M: IFNa skews Monocyte Differentiation into CD56+ expressing dendritic cells with potent functional activities in vitro and in vivo. J Immunol 2008, 180:1462-70
- Korthals M, Safaian N, Kronenwett R, Maihöfer D, Schott M, Papewalis C, Diaz Blanco E, Winter M, Czibere A, Haas R, Kobbe G und Fenk R: Monocyte derived dendritic cells generated by IFN-alpha acquire mature dendritic and natural killer cell properties as shown by gene expression analysis. J Transl Med 2007, 25: 46
- Schott M, Sagert C, Willenberg H, Ramp U, Varro A, Schinner S, Eisenberger C, Raffel A und Scherbaum WA: Carcinogenic hypergastrinemia: Signet ring cell carcinoma in a patient with multiple endocrine neoplasia type 1 with Zollinger-Ellison’s Syndrome J Clin Endocrinol Metab2007, 92: 3378-82
- Cupisti K, Wolf A, Raffel A, Schott M, Miersch D et al.: Long term clinical follow up in medullary thyroid carcinoma – (A single institution’s experience over 20 years). Ann Surg 2007 , 246:815-821
- Schott M, Willenberg HS, Jung M, Knoefel WT und Scherbaum WA: Identification of occult metastases of medullary thyroid carcinoma by pentagastrin-stimulated intravenous sampling. Clin Endocrinol (Oxf) 2007, 66: 405-9
- Schott M: Immunesurveillance by dendritic cells: potential implication for immunotherapy of endocrine cancers. Endocrine-Related Cancer 2006, 13: 779-95
- Papewalis C, Fassnacht M, Willenberg HS, Domberg J, Schinner S, Bornstein SR, Scherbaum WA und Schott M: Dendritic cells as potential adjuvant for immunotherapy in adrenocortical carcinoma. Clin Endocrinol 2006, 65: 215-22
- Schott M, Scherbaum WA und Seissler J: Dendritic cell immunotherapy in thyroid malignancies. Curr Drug Targets 2004, 4(3):245-51
- Schott M, Seissler J und Scherbaum WA: IGF-1, IGF-BP3, and cancer risk. Lancet 2004, 364: 325 (letter)
- Schott M, Reincke M, Ortmann D und Bornstein SR: Immunotherapy: new strategies for the treatment of adrenocortical carcinoma. Horm Metab Res 2003, 35 (7): 451-453
- Schott M und Seissler J: Dendritic cell vaccination: new hope for the treatment of metastasized endocrine malignancies. Trends Endocrinol Metab 2003, 14(4): 156-162
- Krüger T, Wohlrab U, Klucken M, Schott M und Seissler J: Development of a dendritic cell vaccine for the antigen-specific suppression of cyclophosphomide diabetes in NOD mice. Diabetologia 2003, 46: 1357-1365
- Schott M, Feldkamp J, Klucken M, Kobbe G, Scherbaum WA und Seissler J: Calcitonin-specific antitumor immunity in medullary thyroid carcinoma following dendritic cell vaccination. Cancer Immunol Immunother 2002, 51: 663-66
- Schott M, Feldkamp J, Lettmann M, Fouxon V, Scherbaum WA und Seissler J: Immunotherapy for medullary thyroid carcinoma by dendritic cell vaccination. J Clin Endocinol Metab 2001, 86:4965-9
- Schott M, Feldkamp J, Lettmann M, Simon D, Scherbaum WA und Seissler J: Dendritic cell immunotherapy in a neuroendocrine pancreas carcinoma. Clin Endocrinol (Oxf) 2001, 55(2):271-7
- Schattenberg D, Schott M, Reindl G, Krueger T, Tschoepe D, Feldkamp J, Scherbaum WA und Seissler J: Response of human monocyte-derived dendritic cells to immunostimulatory DNA. Eur J Immunol 2000, 30 (10):2824-31
- Schott M, Feldkamp J, Schattenberg D, Seissler J und Scherbaum WA: Dendritic cell immunotherapy in disseminated parathyroid carcinoma. Lancet 1999, 353:1188-9


