Arbeitsgruppe Küry: Neuroregeneration
Unser Team verfügt über mehrere Schwerpunkte im Bereich der translational-präklinischen Forschung. Zum einen sind wir an neurologischen Erkrankungen, bei denen die so genannte weisse Substanz (Myelin) primär oder sekundär beeinträchtigt wird, interessiert. Dies umfasst neben der Multiplen Sklerose (MS) und peripheren Neuropathien auch ALS, Schlaganfall, Covid-19 und das Down-Syndrom. Zum anderen beschäftigen wir uns vorwiegend mit Gliazellen, d.h. mit den Myelin-produzierenden Oligodendrozyten, den Astrozyten und den mikroglialen Zellen sowie deren Vorläuferzellen und mit neuralen Stammzellen des ZNS. Wir möchten verstehen, wie die einzelnen Zelltypen auf Verletzung und Erkrankung reagieren und ob diese Reaktionen eher einen restaurativen oder degenerativen Charakter aufweisen.
Mit p57kip2 konnten wir in der Vergangenheit einen intrinsischen, negativen Regulator der Schwannzell- und oligodendroglialen Reifung identifizieren, der zudem auch das gliale Schicksal von neuralen Stammzellen kontrolliert. Um eine biomedizinische Umsetzung zu ermöglichen, konnten wir eine Reihe von pharmakologischen Substanzen identifizieren, die den p57kip2 Effekt gezielt neutralisieren können. Dabei handelt es sich um Parbendazol, Danazol und Methiazol. Weitere, zum Teil bereits klinisch eingesetzte Substanzen wie Teriflunomid, Medryson, Cladribin oder auch S1PR Modulatoren werden aktuell auf ihre pro-oligodendroglialen Eigenschaften getestet. Hierbei werden auch Effekte auf benachbarte Gliazellpopulationen wie Mikroglia und Astrozyten untersucht, um ggf. begleitende neurotoxische Reaktionen zu beschreiben. Bei dem C21orf91 Gen handelt es sich um einen weiteren intrinsischen Regulator, der in unserem Labor zum ersten Mal beschrieben wurde und der an der glialen Fehlentwicklung beim Down Syndrom beteiligt zu sein scheint. Aktuelle Untersuchungen befassen sich mit dem zugrunde liegenden Wirkmechanismus sowie der Beschreibung von geeigneten, neutralisierenden pharmakologischen Substanzen.
In einer Vielzahl von Studien konnten wir zusammen mit einem internationalen Konsortium, zeigen, dass das bei MS aktivierte, endogene Retrovirus HERV-W sowohl oligodendrogliale Vorläuferzellen in ihrer Reifung und Regenerationsreaktion hemmt als auch mikroglialen Zellen einen aggressiven Charakter verleiht. Diese Human-spezifische Entität ist bereits erfolgreich im MS Patienten mittels Antikörper (Temelimab) neutralisiert worden und es konnte somit eine anti-regenerative und pro-degenerative Rolle von HERV-W indirekt bestätigt werden. Aktuelle Untersuchungen befassen sich mit der direkten Studie des HERV-W Hüllproteins im Zusammenhang mit Neuroinflammation, Myelindegeneration- und Regeneration bei MS und Covid-19. Hier interessieren wir uns vor allem für die spezifischen Reaktionen der Hauptgliazelltypen (Mikroglia, Astroglia, oligodendrogliale Vorläuferzellen und reife Oligodendrozyten).
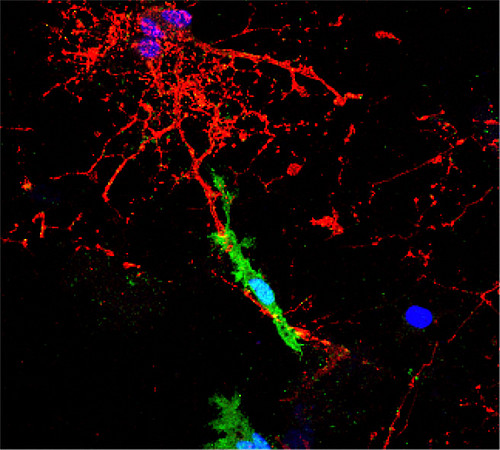
Abbildung: Eine in Kultur mittels des HERV-W Hüllproteins ENV getriggerte mikrogliale Zelle (grün) steht in direktem Zell/Zellkontakt mit Myelinscheiden (rot).




