Molekulares & funktionelles Neuroimaging
Die Arbeitsgruppe ist am Forschungszentrum Jülich tätig. Weitere Informationen finden Sie unter http://www.fz-juelich.de/inm/inm-2/DE/Home/home_node.html
Forschungsschwerpunkte
Wir untersuchen metabolische und neurochemische Prozesse, die neurologischen und psychiatrischen Erkrankungen (z. B. M. Alzheimer, Depression) sowie fundamentalen Funktionen des Gehirns (z. B. Schlaf-Wach-Regulation) zugrunde liegen. Dabei kommt eine Vielzahl von bildgebenden und analytischen Techniken, u. a. Positronenemissionstomographie (PET), funktionelle und pharmakologische Magnetresonanztomographie (f/phMRT), Elektroezephalographie (EEG), Autoradiographie, Kleintierbildgebung zur Wirkstoffprüfung und zur Quantifizierung von Prüfsubstanzen zum Einsatz.
Ein Arbeitsschwerpunkt unserer Forschung liegt in der Analyse der Verteilung und Regulation von Neurotransmitterrezeptoren im menschlichen Gehirn mittels multimodaler Bildgebung. Ein wichtiger methodischer Schwerpunkt unserer präklinischen Forschung liegt auf der Wirkstoffprüfung von diagnostischen und therapeutischen Arzneimitteln.
Das Hauptziel unserer klinischen Forschung liegt in der Entwicklung von hochspezifischen neurochemischen Indikatoren für Hirnerkrankungen, welche eine sichere Diagnose bereits in einem frühen Krankheitsstadium erlauben und als diagnostische Instrumente bei der Alzheimer, der Parkinson oder der Huntington-Erkrankung sowie bei Multipler Sklerose, Depression, Epilepsie und Schizophrenie geeignet sind. In diesem Rahmen sind wir auf die Durchführung von klinischen Studien spezialisiert, bei denen die molekulare Bildgebung als Evaluationsinstrument im Zulassungsprozess von Prüfsubstanzen eingesetzt wird.
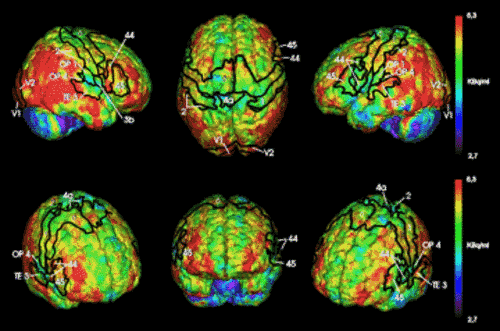
In einem Beispiel für klinische Studien zeigen sich Serotonin-5-HT2A-Rezeptorveränderungen bei Progressiver Supranukleärer Paralyse.
Der 5-HT2A-Rezeptor wird nicht nur in neokortikalen Regionen exprimiert und daher an kognitiven Prozessen beteiligt, sondern er spielt auch eine wichtige Rolle in Mittelhirnstrukturen, die an der Planung und Ausführung von motorischen Programmen beteiligt sind. Zusammen mit der Klinik für Neurologie der Universität Marburg haben wir seine Rolle beim atypischen Parkinsonsyndrom PSP (Progressive Supranukleäre Paralyse) untersucht. Diese Erkrankung ist verwandt mit der Parkinsonerkrankung, zeigt allerdings zusätzliche Symptome wie Schwierigkeiten beim Bewegen der Augen (Blicklähmung), plötzliche, unvorhersehbare Stürze, Sprechprobleme und subkortikale Demenz. Eine ursächliche bzw. effektive symptomaitische Therapie ist bislang nicht bekannt.
Wir konnten nun erstmals zeigen, dass es zu einer Aufregulation der 5-HT2A-Rezeptors in Hirnregionen kommt, die für die Bewegungskontrolle maßgeblich sind (siehe Abbildung 6). Damit könnte sich eine therapeutische Option über eine gezielte medikamentöse Modulation dieser vermehrt exprimierten Rezeptoren eröffnen.

Ausgewählte aktuelle Publikationen
- Elmenhorst, D. ; Kroll, T. ; Wedekind, F. ; Weißhaupt, A. ; Beer, S. ; Bauer, A. In Vivo Kinetic and Steady-State Quantification of 18F-CPFPX Binding to Rat Cerebral A1 Adenosine Receptors: Validation by Displacement and Autoradiographic Experiments. Journal of nuclear medicine 54(8), 1411-1419 (2013) [10.2967/jnumed.112.115576] GO
- Kroll, T. ; Elmenhorst, D. ; Matusch, A. ; Wedekind, F. ; Weißhaupt, A. ; Beer, S. ; Bauer, A. Suitability of [18F]Altanserin and PET to Determine 5-HT2A Receptor Availability in the Rat Brain: In Vivo and In Vitro Validation of Invasive and Non-Invasive Kinetic Models. Molecular imaging & biology 15(4), 456-467 (2013) [10.1007/s11307-013-0621-3] GO
- Kroll, T. ; Matusch, A. ; Celik, A. A. ; Wedekind, F. ; Weißhaupt, A. ; Beer, S. ; Bauer, A. [18F]Altanserin and small animal PET: Impact of multidrug efflux transporters on ligand brain uptake and subsequent quantification of 5-HT2A receptor densities in the rat brain. Nuclear medicine and biology 00(00), 00 (2013) [10.1016/j.nucmedbio.2013.09.001] GO
- Elmenhorst, D ; Meyer, P. T. ; Matusch, A. ; Winz, O. H. ; Bauer, A. Caffeine Occupancy of Human Cerebral A1 Adenosine Receptors: In Vivo Quantification with 18F-CPFPX and PET. Journal of nuclear medicine 53(11), 1723 - 1729 (2012) [10.2967/jnumed.112.105114] GO
- Elmenhorst, D. ; Aliaga, A. ; Bauer, A. ; Rosa-Neto, P.Test-Retest Stability of Cerebral mGluR5 Quantification Using [11C]ABP688 and Positron Emission Tomography in Rats. Synapse 66, 552 - 560 (2012) [10.1002/syn.21542] GO
- Elmenhorst, D. ; Kroll, T. ; Matusch, A. ; Bauer, A.
- Sleep Deprivation Increases Cerebral Serotonin 2A Receptor Binding in Humans. Sleep 35(12), 1615-23 (2012) [10.5665/sleep.2230] GO
- Savil, M. ; Bauer, A. ; Mitterhauser, M. ; Ding, Y. S. ; Hahn, A. ; Kroll, T. ; Neumeister, A. ; Hauesler, D. ; et, a. Normative database of the serotonergic system in healthy subjects using multi-tracer PET. NeuroImage 63, 447 - 459 (2012) [10.1016/j.neuroimage.2012.07.001] GO