Die Rolle des Faktors Nukleolin in CD34+ Zellen bei der akuten myeloischen Leukämie
Die akute myeloische Leukämie (AML) ist eine aggressive Blutkrebsform und die häufigste Form akuter Leukämien bei Erwachsenen, mit ca. 4000 neuen Krankheitsfällen jährlich in Deutschland. Die Leukämie Lymphom Aktuell hat in der Ausgabe Nr. 66 über die AML berichtet.
Die normale Blutbildung ist ein komplexer, mehrstufiger Prozess, bei dem alle blutbildenden Zellreihen aus Stammzellen hervor gehen. Blutbildende Stammzellen sind in jedem Individuum verfügbar und können sich zu Vorläuferzellen entwickeln, woraus im Laufe der weiteren Differenzierung reife Zellen entstehen. Etwas ähnlich wie die normale Blutbildung, folgt auch die AML einer hierarchischen Struktur, wobei abnormale Leukämie-Stammzellen für die Entwicklung und Wiederkehr der AML eine zentrale Rolle spielen. Das Verständnis von Leukämie-Stammzellen bietet eine erfolgversprechende Basis für ein verbessertes Verständnis der AML sowie für neue Therapieansätze.
Dabei ist Nukleolin ein multifunktionales Protein, welches für die Krebsforschung eine hohe Relevanz hat. So ist beispielsweise eine hohe Expression von Nukleolin mit einer schlechten klinischen Prognose bei bestimmten Tumorentitäten des Menschen verbunden. Nukleolin wird auch als bedeutendes Kandidaten-Zielmolekül für die Therapie bestimmter maligner Erkrankungen angesehen. Unsere Arbeitsgruppe hat erstmals beschrieben, dass Nukleolin darüber hinaus eine Schlüsselfunktion für die Genregulation und die Aufrechterhaltung der Zellen im normalen blutbildenden Stammzellkompartiment hat (in normalen blutbildenden Stammzellen und Vorläuferzellen).
Für wissenschaftliche Untersuchungen der normalen und abnormalen Blutbildung ist es wichtig, dass der Differenzierungsgrad von Zellen mit Hilfe eines charakteristischen Musters an Zelloberflächenmolekülen bestimmt werden kann. Dabei dient das bekannte CD34 Protein an der Zelloberfläche als Marker von Zellen aus dem normalen blutbildenden Stammzellkompartiment und steht auch mit dem Stammzellkompartiment bei der AML im Zusammenhang. Wir konnten zeigen, dass Nukleolin die Expression von CD34 über einen von uns beschriebenen molekularen Mechanismus aktiviert und hierdurch den CD34+ Phänotyp von hämatopoetischen Zellen bestimmt.
Von Bedeutung in diesem Geschehen ist auch der Wnt-Signalweg, wodurch die Zellen auf bestimmte äußere Signale reagieren können. Der Wnt-Signalweg ist ein grundlegender Aktivierungsablauf in der Zelle, welcher an der Regulation von Stammzellen sowie an den Vorgängen der Embryonalentwicklung, der Gewebeerneuerung und -Regeneration beteiligt ist. Eine kontrollierte Aktivität des Wnt-Signalwegs ist für die Regulation des normalen blutbildenden Stammzellkompartimentes mit verantwortlich. Eine Deregulation des Wnt-Signalwegs hingegen ist an der Erhaltung von Leukämie-Stammzellen und der AML beteiligt. Unsere Daten zeigen, dass Nukleolin den Wnt-Signalweg in hämatopoetischen Zellen aktivieren kann bzw. die Funktion dieses Signalwegs unterstützt. Darüber hinaus kann Nukleolin, über noch unvollständig erforschte Mechanismen, das Level von bestimmten molekularen Regulatoren des Wnt-Signalwegs in der Zelle beeinflussen. Da Nukleolin auch an der malignen Zelltransformation beteiligt ist, deuten unsere Ergebnisse darauf hin, dass dessen Deregulation zum Zustandekommen einer abweichenden Aktivität des Wnt-Signalwegs in der AML beitragen könnte.
Für die großzügige Unterstützung unserer Forschung möchte ich mich bei der Leukämie Lymphom Liga e.V. und deren Spender:innen herzlich bedanken.

PD Dr. Edgar Grinstein
Research Group Leader
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf
TRANS-AML-EU: Jede Leukämie ist anders
Europäisches Forschungsprojekt der LLL und der Universitätsklinik Düsseldorf zur personalisierten Therapie der AML
Das europäische Forschungsprojekt TRANS-AML-EU kurz erklärt
Akute Myeloische Leukämie (AML) verläuft bei jeder Patientin und jedem Patienten anders. TRANS-AML-EU ist ein Zusammenschluss von Kliniken, Forschungsteams und der Leukämie Lymphom Liga Düsseldorf (LLL) in mehreren europäischen Ländern. Unser gemeinsames Ziel: Aus vielen Laborinformationen, etwa Genetik, Zellmerkmalen und dem Ansprechen auf Medikamente, werden biologische Muster abgeleitet. Diese Muster nennen wir DDHMs („Data-Driven Hallmarks“), welche assoziiert sind mit bestimmten klinischen Verläufen, wie zum Beispiel einer günstigen Prognose oder einem besonders guten Ansprechen auf eine Therapieoption. Um diese DDHMs zu messen, erstellen wir TTBs („Translational Tool Boxes“): kleine, standardisierte Testpakete mit klaren Anleitungen und Entscheidungshilfen für das Behandlungsteam. So soll personalisierte Therapie schneller, verlässlicher und breiter verfügbar werden, auch außerhalb großer Spitzenzentren.
Medikamententests im Labor zur Therapieauswahl?
Beim „Drug Screening“ werden Leukämiezellen im Labor mit vielen verschiedenen Medikamenten in Kontakt gebracht. Man sieht dadurch, welche Wirkstoffe einen direkten Effekt auf die Zellen haben: unabhängig davon, ob eine einzelne Genveränderung mit bekanntem Einfluss auf das Therapieansprechen festgestellt werden kann oder nicht. Das hilft, Therapieoptionen zu priorisieren, Nebenwirkungen unnötiger Behandlungen zu vermeiden und bei einem Rückfall rascher zu reagieren. Gleichzeitig zeigt das Screening, warum manche Medikamente nicht wirken: Zellen können Ausweichwege nutzen oder „resistente“ Zellgruppen enthalten. Dieses Wissen wird in DDHMs mit einer Vielzahl anderer Eigenschaften kombiniert und macht zukünftige Entscheidungen gezielter.
DDHMs – die persönliche Krankheitssignatur
Statt nur einen Befund (z. B. eine Mutation) zu betrachten, fassen DDHMs viele Messwerte zu einer individuellen Signatur zusammen. Jede:r Patient:in bekommt mehrere DDHM-Werte wie einen „Krankheits-Fingerabdruck“. Das bildet die Realität besser ab, denn in der AML können mehrere verschiedene Gruppen von Zellen, sogenannte „Klone“, mit unterschiedlichen Eigenschaften gleichzeitig vorkommen. DDHMs helfen, diese Vielfalt sichtbar zu machen und mit bekannten Wirkmechanismen der Medikamente zu verknüpfen.
TTBs: Werkzeugkisten für die Klinik
Um diese komplexe Diagnostik im klinischen Alltag anwendbar zu machen, haben wir uns zum Ziel gesetzt, die DDHMs auf die wichtigsten Parameter zu reduzieren und so einfacher messbar zu machen. Die dafür benötigten Methoden sollen in den Translational Tool Boxes „TTBs“ zusammengefasst werden. Diese TTBs lassen sich dann, so ist der Plan des Forschungskonsortiums, relativ einfach auch außerhalb der großen Forschungskliniken installieren. Die Datenanalyse erfolgt dabei zentral, da die individuellen Messergebnisse mit den Eigenschaften anderer Patienten abgeglichen werden und so die Tests kontinuierlich verbessert werden sollen. Insbesondere kann die Diagnostik so mit den immer neuen Therapien Schritt halten, um auch dort das Ansprechen zu verbessern.
Datenschutz zuerst: Anonymisierung und sichere Datenwege
Medizinische Daten sind sensibel. TRANS-AML-EU setzt auf Anonymisierung und sichere, europäisch konforme Datenwege. Wo immer möglich, werden nur nicht-personenbezogene Daten geteilt; auf Namen oder direkte Zuordnung wird verzichtet. Einheitliche Qualitätsstandards sorgen dafür, dass Ergebnisse vergleichbar und vertrauenswürdig sind bei gleichzeitig hohem Datenschutz.
Die LLL mittendrin: Patient:innenstimmen in der Forschung
Die Leukämie Lymphom Liga (LLL) ist aktiver Partner des Projekts. Das bedeutet konkret:
- Patientenbedürfnisse im Fokus: Die LLL prüft mit Info-Materialien und Einwilligungen, verständlich, fair und alltagsnah.
- Gemeinschaft einbinden: Die LLL hilft bei der Gewinnung von Patient:innen für individualisierte Therapie-Studien und sammelt Rückmeldungen, was wirklich hilft.
- Verständlich informieren: Gemeinsam mit den Projektpartnern erstellt die LLL Zusammenfassungen der Forschungstätigkeit und Ergebnisse, zudem informiert die LLL auf Patient:innenveranstaltungen über das Forschungsprojekt und die Konsequenzen zur Patientenversorgung.
Warum ist das wichtig? Weil Forschung besser wird, wenn Betroffene von Anfang an mitreden. So entstehen Studien, die zur Lebensrealität passen und Ergebnisse, die schneller in der Versorgung ankommen.
Warum braucht es die europäische Kooperation?
Um dieses Forschungsprojekt durchzuführen, haben sich einige der führenden europäischen Forschungsgruppen im Bereich der funktionellen Präzisionsmedizin zusammengetan:
Finnisches Institut für Molekulare Medizin, Helsinki
Caroline Heckman koordiniert das Gesamtprojekt und steuert Expertise im Drug Screening sowie in der Datenanalyse bei.
Universitätsklinikum Düsseldorf
Die Arbeitsgruppe um Sascha Dietrich trägt aus der Sicht eines maximalversorgenden Krankenhauses bei. Hier werden komplexe Analysen durchgeführt und modernste Therapien für Patient:innen zur Verfügung gestellt. Aus dieser Situation heraus sollen solche Verfahren auch in die breite Versorgung übertragen werden.
Karolinska Institut, Stockholm
Olli Kallioniemi und sein Team arbeiten daran, die DDHMs zu entwickeln und dadurch die komplexe Biologie von Leukämien in verständliche Eigenschaften zu übersetzen.
Universität Heidelberg
Das Team von Junyan Lu trägt mit langjähriger Expertise in der Bioinformatik, also der Analyse komplexer biologischer Datensätze, zum Projekt bei. Hier werden die Daten aus vielen Zentren harmonisiert und gemeinsam analysiert.
VEIL.AI, Helsinki
VEIL.AI ist auf datenschutzkonforme Anonymisierung und synthetische Daten spezialisiert. Die Firma hilft, Patient:innendaten so zu schützen, dass sie für Forschung und Qualitätskontrolle genutzt werden können, ohne Rückschlüsse auf Einzelpersonen zuzulassen.
Krankenhaus Niguarda, Mailand
Roberto Cairoli und seine Kolleg:innen steuern eine duale Expertise bei: Einerseits haben sie umfassende Erfahrung zur Analyse komplexer Datensätze, andererseits werden am dortigen Zentrum die TTBs pilotiert, um zu sehen, wie gut sie in einem anderen Gesundheitssystem funktionieren.
Universitätsklinikum Vilnius
Dieses litauische Zentrum zeigt unter der Leitung von Andrius Zucenka, wie die neuen Werkzeuge auch in Regionen eingesetzt werden können, wo weniger Ressourcen zur Verfügung stehen. So wird geprüft, ob TTBs wirklich dezentral und europaweit nutzbar sind.
Leukämie Lymphom Liga e.V.
Die LLL, vertreten durch den Vorsitzenden Reinhard Christel, vertritt die Stimme der Patient:innen und ihrer Familien. Sie achtet darauf, dass deren Bedürfnisse im Mittelpunkt stehen, unterstützt bei der Rekrutierung für Studien und erstellt verständliche Informationsmaterialien und Berichte.
Auch Sie möchten sich aktiv in der Forschung einbringen? Melden Sie sich gerne bei der Geschäftsstelle der LLL, um mehr über die Möglichkeiten sich aktiv einzubringen zu erfahren.
Begriffserklärungen
DDHMs: Data-Driven Hallmarks – datenbasierte Krankheitsmerkmale
DDHMs sind biologische Muster, die aus vielen Laborinformationen (z. B. Genetik, Zellmerkmale, Medikamentenwirkung) abgeleitet werden. Sie zeigen typische Eigenschaften der Erkrankung und helfen vorherzusagen wie ein Patient oder eine Patientin auf eine Therapie anspricht. Man kann sie sich wie einen „Krankheits-Fingerabdruck“ vorstellen.
TTBs: Translational Tool Boxes – Übersetzungs-Werkzeugkästen
Standardisierte Testpakete, mit denen die im Labor gewonnenen Erkenntnisse (z. B. DDHMs) praktisch in der Klinik angewendet werden können. Sie enthalten Anleitungen und Entscheidungshilfen für Ärzt:innen, um Therapien individuell anzupassen.
Drug Screening: „Medikamententest“
Ein Labortest, bei dem Leukämiezellen mit verschiedenen Medikamenten in Kontakt gebracht werden, um zu sehen, welche Wirkstoffe am besten wirken. So können vielversprechende Therapien erkannt und unwirksame oder belastende Behandlungen vermieden werden.
Funktionelle Präzisionsmedizin
Ein Ansatz, bei dem Medikamente direkt an den Krebszellen eines Patienten getestet werden, um herauszufinden, welche Therapie individuell am besten wirkt, statt nur aufgrund von Genveränderungen zu entscheiden.
Klonale Vielfalt
Bezeichnet das gleichzeitige Vorhandensein verschiedener Zellgruppen („Klone“) innerhalb einer Leukämie. Diese können unterschiedlich auf Therapien reagieren. DDHMs helfen, diese Vielfalt sichtbar zu machen.

Herr Dr. med. Peter Bruch
Clinician Scientist
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf
New England Journal of Medicine: Seltene Nebenwirkung der CAR T-Zell-Therapie aufgklärt

Oberarzt, Leiter der allogenen Stammzelltransplantation,
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf

Direktor
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf
Die CAR T-Zell-Therapie ist eine neuartige Behandlungsmethode für Patienten mit Krebsarten des Blutes und des Immunsystems. Dabei werden Immunzellen des Patienten durch eine Apherese aus dem Blut entnommen und im Labor so verändert, dass sie nach der Rückgabe im Patienten gezielt Tumorzellen angreifen und zerstören können.
Bisher gibt es zugelassene CAR T-Zell-Therapien für maligne B-Zell Lymphome (NHL, Lymphdrüsenkrebs), das Multiple Myelom (MM) und die akute B-Zell (lymphatische) Leukämie (ALL). Aber auch für andere Krebserkrankungen und sogar für einige Autoimmunerkrankungen sind CAR T-Zell-Therapien in der Erprobung.
Auch in Düsseldorf werden seit einigen Jahren CAR T-Zell-Therapien bei diesen Erkrankungen durchgeführt. Im letzten Jahr gab es eine Meldung der amerikanischen Gesundheitsbehörde FDA und später auch der europäischen Arzneimittelbehörde EMA, dass in seltenen Fällen nach der Behandlung mit CAR T-Zellen weitere bösartige Erkrankungen, unter anderem auch so genannte T-Zell-Lymphome auftreten können. Hieraus ergab sich der Verdacht, dass die genetischen Veränderungen der Immunzellen während des Herstellungsprozesses möglicherweise für die Entwicklung dieser Zweittumoren verantwortlich sein könnten. Da weltweit bisher nur wenige T-Zell-Lymphome beschrieben worden waren und diese bisher nur in Einzelfällen gründlich untersucht wurden, blieb bisher unklar, wodurch genau diese sekundären T-Zell-Lymphome verursacht werden.
Wir konnten nun anhand eines Patientenfalles, der sich in Düsseldorf ereignete, einen wichtigen Mechanismus für die Entstehung dieser CAR T-Zell-Lymphome durch sorgfältige genetische Untersuchungen klären. Unser Patient war an einem Lymphom des zentralen Nervensystems erkrankt und entwickelte etwa zwei Monate nach der CAR T-Zell-Therapie ein aggressives CAR T-Zell-Lymphom. Er verstarb daran trotz einer intensiven Therapie und Betreuung auf der Intensivstation.
Gemeinsam mit Wissenschaftlern aus Berlin, Lübeck, Heidelberg und Basel haben wir zahlreiche Proben des Patienten untersucht, die von den Lymphomzellen und zu verschiedenen Zeitpunkten vor, während und nach der CAR T-Zell-Therapie entnommen worden waren. Hierbei fanden sich in dem T-Zell-Lymphom nicht nur der CAR-Vektor, sondern unter anderem auch mehrere Mutationen in den Genen DNMT3A und TET2, die sehr wahrscheinlich für die bösartige Transformation verantwortlich waren. Mit hochempfindlichen Gensonden konnten diese Mutationen aber bereits vor der eigentlichen Behandlung im Patientenblut in Spuren nachgewiesen werden. Mehr noch, einige dieser Mutationen fanden sich nicht nur in T-Zellen, sondern auch in anderen Blutzellen und sogar in Blutstammzellen, die Monate vor der eigentlichen Herstellung der CAR T-Zellen gewonnen worden waren. Diesen Zustand nennt man klonale Hämatopoese. Hierbei dominieren einige mutierte Blutstammzellen die Blutbildung, ohne dass es bereits zu einer bösartigen Erkrankung gekommen ist. Dieser Zustand kann im Alter auftreten, aber auch durch Chemotherapie oder Bestrahlung begünstigt werden.
Gleichzeitig haben wir die CAR T-Zellen auch akribisch darauf untersucht, ob in ihnen durch die genetischen Veränderungen während des Herstellungsprozesses möglicherweise Tumorgene induziert oder aktiviert worden waren. Dies war nicht der Fall, so dass wir anhand der hochempfindlichen genetischen Untersuchungen nachweisen konnten, dass sich die Anlage für das bösartige T-Zell-Lymphom in Form der klonalen Hämatopoese schon vor der CAR T-Zell-Therapie im Patienten befand. Ähnliche Hinweise fanden andere Forscher bei anderen Fällen, jedoch konnte bisher in keinem Fall die Beweiskette so lückenlos geführt werden wie in dem Fall aus Düsseldorf.
Welche Konsequenzen ergeben sich nun daraus? Insgesamt ist das Risiko, an einem sekundären T-Zell-Lymphom nach einer CAR T-Zell-Therapie zu erkranken, sehr gering. Bisher wurden weltweit bei einer Gesamtzahl von weit mehr als 40.000 Behandlungen nur etwa 40 Fälle beobachtet. In keinem Fall konnte bisher gezeigt werden, dass die genetische Veränderung der Immunzellen selbst die Ursache für die Zweittumoren war. Vielmehr zeigt unser Fall sehr eindrücklich, dass bestimmte Voraussetzungen der Blutbildung bereits im Patienten gegeben sein müssen, damit ein sekundäres T-Zell-Lymphom nach einer CAR T-Zell-Therapie entstehen kann.
In Zukunft sollen Patienten vor einer CAR T-Zell-Therapie genauer auf möglicherweise bereits vorhandene Mutationen untersucht werden, um das Risiko für diese schwere Komplikation in Zukunft noch besser einschätzen zu können. Die Ergebnisse der Düsseldorfer Untersuchungen wurden aktuell im renommierten New England Journal of Medicine ( https://www.nejm.org/doi/full/10.1056/NEJMoa2402730) publiziert.
Oktober 2024
CD20-bispezifische Antikörper verbessern die Wirkung von CD19-CAR-T-Zellen bei Lymphomen und CLL

Wissenschaftliche Mitarbeiterin
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf

Assistenzarzt/ Clinician Scientist
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf

Direktor
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf
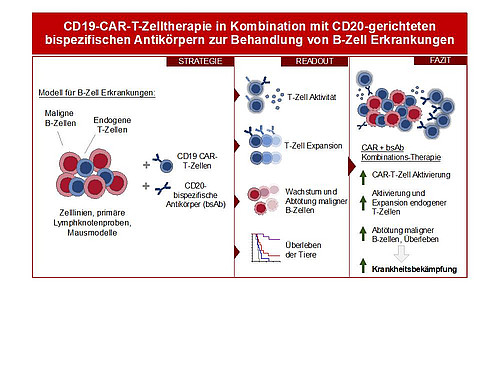
Wissenschaftler*innen der Klinik für Hämatologie, Onkologie und Klinische Immunologie am Universitätsklinikum Düsseldorf haben in Kooperation mit dem Deutschen Krebsforschungszentrum (DKFZ) und der Universitätsklinik Heidelberg die Kombination von therapeutischen Immunzellen, den sogenannten CAR-T-Zellen, und bispezifischen Antikörpern untersucht. In Zell- und Tiermodellen testeten sie die Kombination von CAR-T-Zellen, die gegen den B-Zell-Marker CD19 gerichtet sind, und bispezifischen Antikörpern, die an das B-Zell-spezifische Protein CD20 binden. Die Kombinationstherapie führte zur Vermehrung von Immunzellen und dadurch zu einer verstärkten Zerstörung von bösartigen B-Zellen. Die Kombination dieser beiden modernen Therapieverfahren kann in der Zukunft die Behandlung von Lymphomen und Leukämien verbessern.
Seit einigen Jahren wird für die Behandlung einiger Krebserkrankungen des Blut- und Lymphsystems eine neue Art der Immuntherapie - die sogenannte CAR-T-Zell-Therapie - eingesetzt, mit welcher zum Teil große Erfolge erzielt werden (CAR: Chimärer Antigen-Rezeptor). Wir berichteten hierüber zuletzt in der Ausgabe Nr. 64. Für diese Art der Immuntherapie werden patienteneigene T-Zellen, welche im gesunden Immunsystem für die Zerstörung von erkrankten Zellen verantwortlich sind, isoliert und außerhalb des Körpers gentechnisch mit einem Rezeptor ausgestattet, der eine Zielstruktur auf der Oberfläche von malignen B-Zellen erkennt. Häufig handelt es sich hier um das Protein CD19, das Krebszellen bei B-Zell-Lymphomen und -Leukämien auf ihrer Oberfläche aufweisen. Die CAR-T-Zellen werden dann vermehrt und dem Patienten über eine Infusion zurückgegeben. Sie können dann an das CD19-Oberflächenprotein der malignen B-Zellen andocken und diese dadurch zerstören. Leider sprechen nicht alle Patienten auf die Therapie an oder die Therapie-Wirkung versagt nach einiger Zeit. Mögliche Gründe dafür sind, dass die Krebszellen die Expression des Zielmoleküls CD19 verlieren, dass die CAR-T-Zellen erschöpft sind oder dass sie sich im Körper des Patienten nicht ausreichend vermehren.
Um die therapeutische Wirkung der CAR-T-Zell-Therapien zu verbessern, werden derzeit verschiedene klinische Studien durchgeführt. Unter anderem wird die Kombination von CAR T-Zellen, die gegen zwei verschiedene Antigene gerichtet sind, getestet (z.B. CD19 und CD20). Darüber hinaus werden bei Patienten, bei denen die CD19-CAR-T-Zelltherapie versagt hat, bereits sogenannte bispezifische Antikörper getestet, die einerseits CD20 und andererseits ein T-Zell-spezifisches Molekül erkennen. Auf diese Weise bringen die Antikörper Krebs-Zellen und T-Zellen zusammen und ermöglichen es den Immunzellen, die Krebszellen zu töten.
Basierend darauf ist die Hypothese entstanden, dass die Kombination von CAR-T-Zellen und bispezifischen Antikörpern eine doppelte Wirkung haben könnte.
Und tatsächlich zeigte sich in Zellkultur-Experimenten, dass die Kombination von CD19-CAR-T-Zellen und bispezifischen anti-CD20-Antikörpern zu einer erhöhten Expansion von sowohl CAR-T-Zellen als auch normalen T-Zellen führt, wodurch wiederum mehr maligne B-Zellen abgetötet werden können. Auch in Tierexperimenten konnte durch die Kombination der beiden Medikamente eine höhere Wirksamkeit gegen Leukämiezellen nachgewiesen werden. Die Kombinationstherapie konnte den Blutkrebs in 80 Prozent der Tiere vollständig zurückdrängen. Im Gegensatz dazu führte die CD19-CAR-T-Zell-Therapie alleine nur in 20 Prozent der Tiere zu einer dauerhaften Reduzierung der Blutkrebszellen. Gründe für die deutlich bessere Wirksamkeit der Kombinationstherapie ließen sich aus funktionellen Analysen ableiten. Hier zeigte sich, dass bispezifische anti-CD20-Antikörper die Expressionslevel einiger Aktivierungsmarker sowohl in CAR-T-Zellen als auch in normalen T-Zellen erhöhten. Bei normalen T-Zellen förderten die bispezifischen Antikörper zudem die Proliferation und Zytotoxizität.
Bispezifische anti-CD20-Antikörper sind bereits für die Behandlung von bestimmten Lymphomen zugelassen. Daher könnte eine Kombinationstherapie eine vielversprechende Behandlungsalternative für CLL-Patienten sein, die auf herkömmliche Therapien nicht ansprechen. Ob dieses Behandlungskonzept auch beim Menschen erfolgreich ist, muss noch in klinischen Studien getestet werden.
Berit J Brinkmann*, Alessia Floerchinger*, Christina Schniederjohann*, Tobias Roider, Mariana Coelho, Norman Mack, Peter-Martin Bruch, Nora Liebers, Sarah Dötsch, Dirk H. Busch, Michael Schmitt, Frank Neumann, Philipp M. Roessner, Martina Seiffert#, Sascha Dietrich#:
CD20 bispecific antibodies improve response to CD19 CAR T cells in lymphoma in-vitro and CLL in-vivo models
*Geteilte Erstautoren
#Geteilte Letztautoren
Blood 2024, DOI: 10.1182/blood.2023022682
Oktober 2024
SMARTrial-Studie aktuell in Nature Cancer
Studie zu Leukämien und Lymphomen: Vorhersage des Therapieansprechens

Assistenzärztin/ Clinician Scientist
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf

Assistenzarzt/ Clinician Scientist
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf

Direktor
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf
Das Therapieansprechen von Patientinnen und Patienten mit Blutkrebs wird durch eine Vielzahl von Faktoren beeinflusst. Obwohl heutzutage viele Resistenzmechanismen und prognostische Marker bekannt sind, lässt sich immer noch nicht sicher vorhersagen, welche Patienten auf eine bestimmte medikamentöse Therapie ansprechen und welche nicht. Die direkte Untersuchung von primären Leukämie- und Lymphomzellen mit potentiellen Medikamenten kann erheblich dazu beitragen, das Therapieansprechen vorherzusagen und die wirksamste Therapie für den individuellen Patienten zu bestimmen.
Krebszellen können - je nach Erkrankung - mittels Blutentnahme, Knochenmarkspunktion oder Biopsie isoliert werden. Diese Zellen können dann außerhalb des Körpers mit einer Vielzahl an Medikamenten behandelt werden, um die wirksamste Therapie vorherzusagen. Noch ist die direkte Anwendung dieser Technologie nicht in der breiten klinischen Praxis angekommen, doch eine Vielzahl an Forschern arbeitet daran.
Die aktuell in der Fachzeitschrift Nature Cancer veröffentlichte Studie „SMARTrial“ unter Leitung von Prof. Dr. Sascha Dietrich, Direktor der Klinik für Hämatologie, Onkologie und Klinische Immunologie des Universitätsklinikums Düsseldorf, hat die Anwendung des sogenannten Drug Response Profiling untersucht. Profiling bedeutet hier, das Therapieansprechen auf verschiedene Chemotherapeutika bei einem individuellen Patienten oder einer Patientin vor Behandlungsbeginn und ohne dass Patienten selbst das Medikament verabreicht bekommen zu testen.
Quelle: Sascha Dietrich
Dafür wurden Krebszellen von Patienten im Rahmen der SMARTrial-Studie mittels Blutentnahme, Knochenmarkspunktion und Biopsien entnommen und außerhalb des Körpers (ex vivo) unter Laborbedingungen mit einer breiten Palette an potentiell wirksamen Medikamenten behandelt. Das Therapieansprechen der Patienten auf verschiedene Standardtherapien wurde dann mithilfe mathematischer Modelle mit dem ex vivo Ansprechen auf eine Vielzahl von Medikamenten abgeglichen. Hierbei konnte gezeigt werden, dass insbesondere die Wirkung verschiedener Chemotherapien durch die ex vivo Untersuchungen vorhergesagt werden konnte.
Ermöglicht werden solche breit angelegten Screening-Untersuchungen, bei denen deutlich mehr Medikamente ex vivo getestet als beim Patienten angewendet werden, durch hochautomatisierte Pipettierverfahren. Diese Verfahren ermöglichen es, hunderte Versuche in sehr geringem Maßstab parallel durchzuführen.
Im Durchschnitt waren die Untersuchungsergebnisse des Drug Response Profilings innerhalb von drei Tagen verfügbar. Damit wäre diese Untersuchung auch für den klinischen Alltag sinnvoll anwendbar, da beispielsweise bei aggressiven hämatologischen Krebserkrankungen in der Regel sehr schnell Therapieentscheidungen getroffen werden müssen.
Bei Patienten mit einer Akuten Myeloischen Leukämie (AML), der größten Einzelgruppe in dieser Studie, konnte das Ansprechen auf die Standardtherapie mit den beiden Medikamenten Daunorubicin und Cytarabin auch über die bereits bekannten genetischen Risiken hinaus vorhergesagt werden. Insbesondere Patienten mit einem ungünstigen genetischen Risikoprofil (nach ELN-22 Leitlinien) profitierten hierbei von dem Profiling.
Ein Beispiel: Ein Studienteilnehmer mit aggressivem Lymphom wurde nach Versagen aller Standardtherapien basierend auf dem ex vivo Medikamentenansprechen seiner Krebszellen mit einer individualisierten Therapie behandelt. Diese Therapie zeigte eine deutliche Wirkung und ermöglichte es diesem Patienten, eine Stammzelltransplantation durchzuführen, die zu einem langfristig guten Ansprechen führte.
Auch wenn weitere Studien notwendig sind, um den genauen Stellenwert dieser Technik in der klinischen Anwendung zu bestimmen, stellt diese Arbeit einen weiteren wichtigen Schritt hin zur vollständig personalisierten Therapie von Blutkrebs dar.
April 2024
FLAMSAClax
Neue Studie zur allogenen Blutstammzelltransplantation in Düsseldorf gestartet

Assistenzärztin
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf

Oberarzt, Leiter der Stammzelltransplantation
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf
An der Klinik für Hämatologie, Onkologie und Klinische Immunologie des UKS ist im Sommer 2023 eine neue Studie zur Verbesserung der Heilungschancen von Patienten mit Akuter Myeloischer Leukämie (AML) und Myelodysplastischen Syndromen (MDS) gestartet.
Viele Patienten, die an einer AML oder einem fortgeschrittenen MDS leiden, können nur durch eine allogene Blutstammzelltransplantation von ihrer Erkrankung geheilt werden, weil das Risiko für einen Rückfall nach einer normalen Chemotherapie sehr hoch ist. Bei diesen Erkrankungen wird also frühzeitig nach einem passenden Spender oder einer passenden Spenderin gesucht, um eine allogene Blutstammzelltransplantation (alloBSZT) durchführen zu können. Bei der alloBSZT wird dann zunächst eine sehr hoch dosierte Chemotherapie durchgeführt. In Einzelfällen wird diese auch noch zusätzlich mit einer Ganzkörperbestrahlung kombiniert. Diese Therapie wird in der Fachsprache „Konditionierung“ genannt.
Nach der Konditionierung wird nach 1 bis 2 Tagen Pause dann das Transplantat eines passenden Spenders oder einer passenden Spenderin über einen zentralen Venenkatheter infundiert. Dieses Transplantat enthält Stammzellen des Blutes, die nach der Transfusion ihren Weg alleine ins Knochenmark finden, dort anwachsen und für viele Jahre neues Blut bilden können. Deshalb kann die Konditionierung vor der Gabe der Stammzellen sehr intensiv gewählt werden – viel intensiver als bei einer normal dosierten Chemotherapie. Die verwendeten Dosierungen sind oft um das 3- bis 10-fache höher. Die Blutstammzellen des Spenders bzw. der Spenderin dienen als Ersatz für die Blutbildung des Patienten, die durch die Konditionierung meist sehr stark geschwächt oder sogar vollständig zerstört wird. Man spricht deshalb auch von einer Hochdosistherapie.
Zusätzlich finden sich im Transplantat neben den Blutstammzellen aber auch Immunzellen des Spenders. Sie machen sogar den überwiegenden Anteil der Zellen im Transplantat aus. Das ist sehr wichtig, weil die Immunzellen des Spenders kranke Blutzellen des Patienten erkennen und zerstören können. Man spricht in diesem Fall vom „Graft-versus-Leukemia“ (GvL) Effekt. Dieser Effekt ist neben der Hochdosistherapie der Grund dafür, dass nach einer allogenen Blutstammzelltransplantation sehr viel weniger Rückfälle von AML und MDS auftreten als nach einer normalen Chemotherapie. Die Transplantation ist also streng genommen eine Chemo- Immuntherapie.
Leider haben die Immunzellen des Spenders gelegentlich auch unangenehme Eigenschaften. Sie können nämlich auch normale Gewebe des Patienten, z.B. Haut, Leber oder auch den Darm als „fremd“ erkennen und angreifen. In diesem Fall spricht man dann von einer „Graft-versus-Host“ (GvH) Reaktion. Sie ist eine der häufigsten Komplikationen nach einer alloBSZT und in der Regel werden nach der Transplantation einige Monate lang Medikamente gegeben, die das Auftreten einer GvH-Reaktion verhindern sollen. Wenn der Spender sehr gut zum Patienten passt, gelingt dies häufig sehr gut.
Obwohl die alloBSZT die wirksamste Behandlung von AML und MDS ist, treten aber auch nach der Transplantation Rückfälle der jeweiligen Grunderkrankung auf. Dies ist insbesondere bei älteren Patienten der Fall, weil bei diesen die Intensität der Konditionierung wegen der Nebenwirkungen nicht unbegrenzt gesteigert werden kann. Sie wird jeweils so hoch dosiert, dass einerseits möglichst viele bösartige Zellen zerstört werden, andererseits aber an den Organen des Patienten (Leber, Lunge, Herz und Nervensystem) möglichst keine schwerwiegenden oder bleibenden Schäden entstehen. Damit die Therapie sicher ist, muss also insbesondere bei älteren Patienten die Dosis der Konditionierung reduziert und an das Alter angepasst werden. Man spricht in diesen Fällen von einer dosisreduzierten Konditionierung.
Nun gibt es seit einigen Jahren ein neues Medikament zur Behandlung akuter Leukämien, das Venetoclax. Es wird als Tablette vor allem bei älteren Patienten zu einer niedrig dosierten Chemotherapie hinzugegeben und verstärkt die Wirkung der Therapie ganz erheblich, ohne zusätzliche Nebenwirkungen an anderen Organen zu erzeugen. Allerdings dauert die Erholung der Blutzellen nach einer Behandlung mit Venetoclax in Kombination mit einer Chemotherapie länger, als wenn man ohne dieses neue Medikament behandelt. Es funktioniert über die Induktion einer Apoptose in den Krebszellen – dabei handelt es sich um eine spezielle Art des Zelltods, der häufig durch eine Chemotherapie in Krebszellen ausgelöst werden kann. Venetoclax verstärkt diese Wirkung und führt deshalb zu besseren Ergebnissen der Chemotherapie.
Bei der sogenannten FLAMSAClax-Studie wird nun das Venetoclax nicht zu einer normalen Chemotherapie sondern zur Konditionierung vor der allogenen Blutstammzelltransplantation hinzugegeben. Die Hoffnung ist, dass mit dieser Kombination sehr viel mehr Krebszellen zerstört werden können als sonst üblich, ohne die Nebenwirkungen der Konditionierung an den anderen gesunden Organen des Patienten zu verstärken. Auf diese Weise könnte man insbesondere bei älteren Patienten hoffentlich die Ergebnisse der Transplantation weiter verbessern.
Die Studie funktioniert nach einem Phase I-II-Schema. Das bedeutet, dass in einer ersten Phase mit einer niedrigen Dosis Venetoclax zusätzlich zur Konditionierung begonnen wird. Wenn jeweils 3 Patienten diese Dosis erfolgreich durchlaufen und gut vertragen haben, wird die tägliche Menge an Venetoclax gesteigert. Insgesamt sind in der Studie 3 Steigerungen vorgesehen. Wenn klar ist, welche Dosis von den Patienten am besten vertragen wird, werden weitere Patienten mit dieser Dosis behandelt, bis insgesamt 38 Patienten behandelt worden sind.
Im Rahmen der Studie werden die Patienten besonders gründlich über die Behandlung aufgeklärt und nach einem speziellen Schema häufig untersucht, um maximale Sicherheit zu garantieren. Gleichzeitig wird die Studie vom Koordinierungszentrum für klinische Studien (KKS) Düsseldorf und einem Komitee von Wissenschaftlern aus Dresden, Regensburg und München überwacht. Neben den Initiatoren aus Düsseldorf nehmen an dieser Studie Kollegen aus den Universitätskliniken in Aachen, Köln, Frankfurt, Jena und München teil. Wir hoffen sehr, dass wir durch dieses innovative Behandlungskonzept langfristig die Ergebnisse der allogenen Blutstammzelltransplantation bei AML und MDS weiter verbessern können.
April 2024
NUTZUNG VON “BIG DATA” FÜR DIE DATENGETRIEBENE KREBSFORSCHUNG
AUFBAU EINES DATA WAREHOUSES IN DER HÄMATOLOGIE

Assistenzärztin/ Clinician Scientist
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf

PhD student Data Warehouse
Klinik für Hämatologie, Onkologie und klinische Immunologie
Universitätsklinikum Düsseldorf
Die Menge an klinischen und molekularen Daten in der Behandlung krebskranker Patienten nimmt stetig zu. Dieser “Datenschatz” ist auch für die Krebsforschung von großer Bedeutung. Mittels Methoden der künstlichen Intelligenz können aus diesen großen Datensätzen wichtige neue Erkenntnisse für die Diagnosestellung und Behandlung von Krebserkrankungen gewonnen werden. In der Hämatologie wird nun ein Data Warehouse aufgebaut, das die klinischen und wissenschaftlichen Daten für Forschungszwecke zusammenführt.
Tagtäglich wird bei der Versorgung krebskranker Patienten eine Fülle an klinischen Daten generiert, die bislang für weitergehende Forschungszwecke kaum genutzt wird. Hierzu zählen beispielsweise Einträge aus der Krankenakte, Laborwerte, Knochenmark- und Gewebeuntersuchungen, Befunde aus radiologischen Untersuchungen, Therapieverordnungen sowie Ansprechen und Nebenwirkungen auf die verabreichten Therapien. Gleichzeitig erfolgt bereits teilweise im Behandlungskontext und im weitaus größeren Maße im wissenschaftlichen Kontext die molekulare Charakterisierung von Krebszellen. Hierbei werden die Krebszellen auf Veränderungen von Genen (Erbmaterial), Eiweißen oder Stoffwechselprodukten untersucht. Um möglichst zielgerichtet zu behandeln, müssen all diese Daten zu einem Gesamtbild zusammengeführt und betrachtet werden (Abbildung 1). Hierbei stellen sowohl die Aufbereitung der Daten aus den unterschiedlichen Quellen als auch die Analyse solch komplexer Datensätze neue medizininformatische und biostatistische Herausforderungen dar und bedürfen der engen Zusammenarbeit von Experten aus den Fachgebieten der Medizin, Informatik, Naturwissenschaften und Statistik (Abbildung 2). Künstliche Intelligenz kann hierbei helfen, in komplexen Daten neuartige und mitunter seltene Muster zu erkennen. Das hieraus gewonnene Verständnis des komplexen Zusammenspiels aus molekularen und klinischen Parametern soll helfen, Therapieansprechen besser vorherzusagen und damit Therapien besser auf den einzelnen Patienten zuzuschneiden. Gleichzeitig ist auch die genaue diagnostische Klassifikation des Patienten eine wichtige Komponente, um mögliche Subtypen einer Krankheit zu identifizieren und gezielt zu behandeln.
Auch in der Klinik für Hämatologie, Onkologie und klinische Immunologie in Düsseldorf haben wir uns dieses ambitionierte Vorhaben zum Ziel gesetzt. In einem interdisziplinären Team, bestehend aus Ärzten, Informatikern, Data Managern und Naturwissenschaftlern, bauen wir aktuell ein sogenanntes „Data Warehouse“ auf. Hierbei handelt es sich um eine komplexe Datenbank, in der zahlreiche klinische und wissenschaftliche Daten aus unserer Abteilung zusammengeführt werden. Ein zentraler Aspekt dieses Projektes ist vor allem das Zusammenführen von klinischen Routinedaten aus z.B. Arztbriefen mit experimentellen Informationen aus unseren Forschungslaboren. In diesem Kontext arbeiten wir unter anderem aktiv an Verbesserungen bei der strukturierten Datenerhebung im klinischen Alltag. Das Data Warehouse kann entscheidend bei der Entwicklung von komplexen statistischen Auswertungsmethoden für die Vorhersage von Krankheitsverläufen und Therapieansprechen beitragen und stellt das Bindeglied zwischen verschiedenen klinischen Fachbereichen dar. Dadurch erhoffen wir uns, in Zukunft Leukämien und Lymphomerkrankungen effektiver behandeln zu können, Nebenwirkungen von Therapien zu reduzieren und die Sicherheit unserer Patienten zu steigern.
April 2024
Teilnahme an der Reduct-Studie - Ausbau der psychoonkolischen Versorgung von Krebserkrankten
Die Leukämie Lymphom Liga möchte auf ein Studienaufruf zu einem psychoonkologischen Forschungsprojekt hinweisen:
Seitens der Abteilung für Psychosomatische Medizin und Psychotherapie am Universitätsklinikum Tübingen wird die Reduct-Studie durchgeführt mit dem Ziel, die psychoonkologische Versorgung von Krebserkrankten durch digitale und ergänzende Versorgungsangebote auszubauen. Im Rahmen der Studie unterstützt das digitale, interaktive Make It-Training Tumorerkrankte. Von zu Hause am eigenen PC, Tablet oder Smartphone können die Betroffenen über vier Monate hinweg für sich Achtsamkeit und weitere hilfreiche Strategien im Umgang mit krankheitsbezogenen Belastungen erlernen. Wöchentlich steht ihnen ein neues Modul mit hilfreichen und wertvollen Informationen zum Thema Krankheitsverarbeitung sowie eine neue Achtsamkeitsübung zur Verfügung.
An der Studie kann kostenfrei teilnehmen, wer:
- in den letzten 12 Monaten eine (erneute) Krebsdiagnose erhalten hat
- sich aufgrund dessen belastet fühlt und sich Unterstützung wünscht
- zwischen 18 und 65 Jahre alt ist
- über einen internetfähigen PC, Tablet oder Smartphone verfügt.
Nähere Informationen zur Studie finden sich auf der Internetseite https://reduct-studie.de/. Bei Interesse an dem digitalen Unterstützungsangebot ist Frau Jana Heinen, Tel.: 07071-2962543, E-Mail: jana.heinen@med.uni-tuebingen.de Ansprechpartnerin.
Stand der Forschung
Die im Volksmund auch als "Blutkrebs" bezeichnete Leukämie ist eines der komplexesten medizinischen Probleme unserer Zeit.Hämatologen unterscheiden zwischen zwei Arten der Krankheit mit insgesamt 15 unterschiedlichen Formen:
- einerseits lymphatische Leukämien, bei denen Lymphknoten, Knochenmark und Milz betroffen sind, und
- andererseits: myeloische Leukämien und Prä-Leukämien (MDS), die sich in erster Linie im Knochenmark abspielen.
Als einzige Einrichtung in Deutschland hat sich die Klinik für Hämatologie, Onkologie und klinische Immunologie an der Düsseldorfer Heinrich-Heine-Universität auf die Erforschung der MDS spezialisiert.
Unter anderem auf der Basis von rund 2.000 hier behandelten MDS-Patienten entstanden zahlreiche Studien als Grundlage für die internationale Forschung. Ebenso wurde eine in der Welt einzigartige Datenbank aufgebaut, auf die heute Spezialisten aus der ganzen Welt zurückgreifen.
Kurz gefasst:
- Leukämie: Eines der komplexesten medizinischen Probleme
- Düsseldorf: Forschungsstandort mit Weltruf
- Problematik: Hohe Kosten und Gefährdung der weiteren Forschung
- Leukämie Lymphom Liga e.V.: Einrichtung eines dringend benötigten Labors und Finanzierung von Geräten und Apparaturen
- Ziel: Aufrechterhaltung des Forschungsbetriebes
Weitere Informationen finden Sie unter:
www.mds-register.de/duesseldorf


