Tumorforschung: Kopf-Hals-Karzinome
Plattenepithelkarzinome im Kopf-Hals-Bereich (im folgenden auch Kopf-Hals-Karzinome oder HNSCC genannt) repräsentieren ca. 6% aller Malignome (1) und sind der fünfthäufigste Krebs weltweit (2). Neben Alkohol- und Nikotinkonsum trägt die lokale Infektion mit onkogenen, humanen Papillomaviren (vornehmlich HPV16 und HPV18) zur Onkogenese bei (3-7).
Bereits Knudsen gelang es, die grundlegende Mitwirkung eines Gens, nämlich des Retinoblastom-Gens (Rb), bei einem erblichen, Malignom-assoziierten Krankheitsbild, dem hereditären Retinoblastom, nachzuweisen. In Folge konnten multiple Arbeitsgruppen zeigen, dass Veränderungen desselben Gens bei vielen sporadischen Tumoren die Onkogenese mitbestimmen (8). So sind die identifizierten Gene oftmals nicht nur beim hereditären Krankheitsbild selbst, sondern auch bei sporadischen Karzinomen für die Tumorentstehung relevant.
Von diesem Grundsatz ausgehend interessierten uns verschiedene Gene, die Tumor-assoziierte Syndrome auslösen und ihre Bedeutung bei Kopf-Hals-Karzinomen. Unter den in Frage kommenden Krankheitsbildern konzentrierten wir uns auf das Li-Fraumeni (LFS) Syndrom (TP53- oder CHK2-Keimbahnmutationen) und die Fanconi-Anämie (FA) (Mutationen in mind. 17 Genen des FA/BRCA-Signalweges (siehe unten) und bei Malignomen insbesondere Ausfälle in BRCA1, BRCA2, BRIP1=FANCJ, PALB2=FANCN, RAD51C=FANCO, SLX4=FANCP und FANCF), die uns gerade in den letzten Jahren besonders beschäftigt.
Die Fanconi-Anämie ist eine genetische Erkrankung, die mit einer hohen Inzidenz an Plattenepithelkarzinomen in verschiedenen Organsystemen einhergeht. Auf zellulärer Ebene ist die FA durch eine chromosomale Instabilität und eine stark erhöhte Empfindlichkeit gegenüber Chemotherapeutika gekennzeichnet, deren Wirkungsweise auf einer Hemmung der DNA-Replikation in der S/G2-Phase durch Querverknüpfungen (Inter- und Intrastrang-Vernetzungen) zwischen den beiden DNA-Strängen beruht. Diese Läsionen werden typischerweise durch Cisplatin oder Mitomycin C verursacht (9), interessanterweise Chemotherapeutika, die auch bei der Therapie von Kopf-Hals-Karzinomen eine maßgebliche Rolle spielen. Die FA wird autosomal rezessiv oder X-chromosomal vererbt und ist klassischerweise durch kongenitale Malformationen, Knochenmarksversagen mit Panzytopenie und einer Neigung zur frühen Ausbildung von Malignomen charakterisiert (10).
Bei FA-Patienten mit einem milden klinischen Verlauf ohne Knochenmarksversagen und bei Patienten nach Stammzelltransplantation kommt es mit zunehmendem Lebensalter zur drastisch erhöhten Inzidenz von soliden, im wesentlichen epithelialen Tumoren – und hier v. a. gynäkologischen Malignomen und Plattenepithelkarzinomen im Kopf-Hals-Bereich und zwar auch ohne die Exposition gegenüber typischen Risikofaktoren. So entwickelten im Alter bis 45 Jahre ca. 50% der nicht-transplantierten FA-Patienten und nahezu 100% der transplantierten Patienten mit FA ein Kopf-Hals-Karzinom (11, 12).
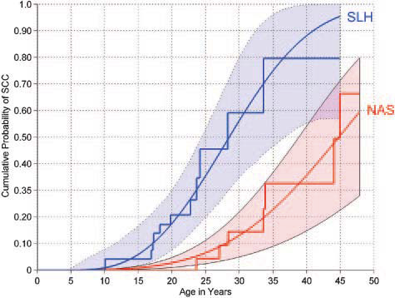
Abb. 1: Nach Rosenberg et al.: Kumulative Wahrscheinlichkeit des Auftretens von Kopf-Hals-Karzinomen bei Patienten mit FA mit (blau; SLH: The Hôpital Saint Louis Transplant Cohort (SLH)) und ohne (rot; The North American Survey Natural History Cohort (NAS)) Stammzelltransplantationen. Auf der X-Achse ist das Alter des Patienten in Jahren aufgetragen, auf der Y-Achse die kumulative Wahrscheinlichkeit, ein HNSCC zu entwickeln (11).
Diese Tatsache läßt vermuten, dass auch bei sporadischen Kopf-Hals-Karzinomen eine defekte Regulation des FA-Signalweges mitwirken könnte. Deshalb beschäftigt sich unsere Arbeitsgruppe mit der potentiellen Mitwirkung von FA-Genen bei der Onkogenese von erblichen und spontanen HNSCC.
Der FA-Signalweg ist ein essentieller Bestandteil der Stoffwechselweges der Homologen Rekombination innerhalb der DNA-Reparatur und relativ komplex. Bei Auftreten eines DNA-Schadens wird ein großer nukleärer Proteinkomplex (FA core complex mit den frühen FA-Genen aktiviert, in dem sich die Produkte der FA-Gene FANC-A/B/C/E/F/G/L/M sowie die interagierende Proteine FA-assoziierten Gene FAAP24 und FAAP100 finden (13, 14). Dieser FA core complex aktiviert die beiden Paraloge FANCD2 und FANCI durch Monoubiquitinierung. Monoubiquitiniertes FANCD2 und FANCI binden im Zellkern im Reparaturfocus an das Chromatin, v.a. an DNA-Anteilen, an denen Doppelstrangbrüche vorliegen und homologe Rekombination abläuft („stalled replication forks“).
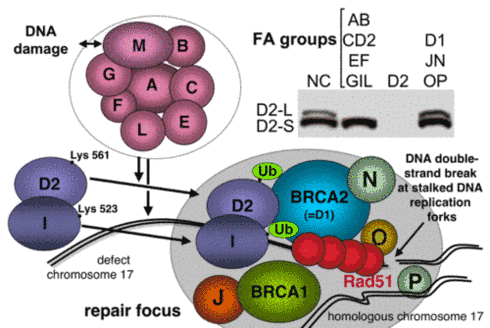
Abbildung 2. Der FA/BRCA-Stoffwechselweg als Teil der Homologen Rekombinations-Reparatur in Zellen.
Uns stehen ca. 30 Kopf-Hals-Karzinomzelllinien zur Verfügung, die es uns erlauben, funktionelle Assays zur Charakterisierung des FA-Signalweges in HNSCC durchzuführen.
In FACS-Untersuchungen haben wir die Empfindlichkeit der Zellen nach Zusetzen von Cisplatin und MMC charakterisiert. Einen Defekt der „frühen“ FA-Gene kann durch einen Western-Blot identifizieren, der das FANCD2-Genprodukt in seiner ubiquitinierten und nicht-ubiquitinierten Form darstellt, identifiziert werden.
Über Mutationsanalysen und epigenetische Untersuchungen (RT-PCR, Methylierungsanalysen) können dann Ursachen für Funktionsverluste der FA-Gene identifiziert werden. In den bisherigen Untersuchungen haben wir in unseren HNSCC-Zelllinien und Patienten Ausfällen in den drei bekannten FA-Genen gefunden. Ein Teil der HNSCC-Zellen ohne FA-Gendefekt zeigt eine klassische FA-like Überempfindlichkeit gegen die cross-linker, allerdings konnten wir in diesen Zelllinien Defekten in den bekannten FA-Genen ausschließen. Deshalb gehen wir davon aus, dass bisher nicht identifizierte FA-Gene hier ursächlich verantwortlich sind. Dies ist Gegenstand intensiver Forschungen.Bei der Identifikation von Defekten des FA-Signalweges in Tumorzellen ist ein klinisch besonders wichtiger Aspekt, deren Auswirkung auf die Chemotherapeutikaresistenzen insbesondere der kreuzvernetzenden Agentien wie z.B. Cisplatin.
Klinisch sind die derzeit anerkannten Therapiemodalitäten von HNSCC sind die chirurgische Therapie, die Radiotherapie und die Chemotherapie mit Platinderivaten als Rückrad der Therapie. In der Regel kommt die operative Tumorentfernung, die Strahlentherapie oder eine Kombination beider Verfahren ggf. begleitet durch eine Chemotherapie (v.a. Cisplatin, Carboplatin, 5-FU, Mitomycin C) zum Einsatz (Dt. Krebsgesellschaft: Leitlinien, 2002).
Besonders bei HPV-positiven Tumoren konnte in den letzten Jahren ein deutlicher Vorteil der Effektivität einer konservativen Therapie gegenüber HPV-negativen Tumoren dargestellt werden (15). Nichtdestotrotz ist nach wie vor die alleinige Chemotherapie bei Patienten mit einem Kopf-Hals-Karzinom kein kurativer Therapieansatz. Hierdurch ist gerade bei Patienten mit Zweit- und Rezidivtumoren, die bereits alle anderen therapeutischen Maßnahmen genutzt haben, die Behandlungsoption oftmals stark beschränkt. Ausserdem limitiert eine Oto- und Nephrotoxizität die Gabe des bei HNSCC vor allem verabreichten Chemotherapeutikums Cisplatin. Eine Umgehung der limitierenden Mechanismen könnte zur Verbesserung der konservativen Therapie und so zu einem Überlebensvorteil der Patienten führen. Hierbei könnte die Untersuchung des FA-Signalweges Aspekte aufzeigen.
Literatur
- Hardisson D. Molecular pathogenesis of head and neck squamous cell carcinoma. Eur Arch Otorhinolaryngol. 2003;260(9):502-8.
- Parkin DM, Bray F, Ferlay J, Pisani P. Estimating the world cancer burden: Globocan 2000. Int J Cancer. 2001;94(2):153-6.
- Syrjanen K, Syrjanen S, Lamberg M, Pyrhonen S, Nuutinen J. Morphological and immunohistochemical evidence suggesting human papillomavirus (HPV) involvement in oral squamous cell carcinogenesis. Int J Oral Surg. 1983;12(6):418-24. Epub 1983/12/01.
- Lothaire P, de Azambuja E, Dequanter D, Lalami Y, Sotiriou C, Andry G, et al. Molecular markers of head and neck squamous cell carcinoma: promising signs in need of prospective evaluation. Head Neck. 2006;28(3):256-69. Epub 2005/11/15.
- Chung CH, Gillison ML. Human papillomavirus in head and neck cancer: its role in pathogenesis and clinical implications. Clin Cancer Res. 2009;15(22):6758-62. Epub 2009/10/29.
- Goon PK, Stanley MA, Ebmeyer J, Steinstrasser L, Upile T, Jerjes W, et al. HPV & head and neck cancer: a descriptive update. Head Neck Oncol. 2009;1(1):36. Epub 2009/10/16.
- Kreimer AR, Clifford GM, Boyle P, Franceschi S. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev. 2005;14(2):467-75. Epub 2005/03/01.
- Knudsen ES, Knudsen KE. Retinoblastoma tumor suppressor: where cancer meets the cell cycle. Exp Biol Med (Maywood). 2006;231(7):1271-81. Epub 2006/07/04.
- D’Andrea AD, Grompe M. The Fanconi anaemia/BRCA pathway. Nat Rev Cancer. 2003;3(1):23-34. Epub 2003/01/02.
- Auerbach A, Buchwald M, Joenje H. The Genetic Basis of Human Cancer. McGraw-Hill, Inc, New York. 2002;2nd Edition B(Vogelstein B, Kinzler KW, Eds. ):289-306.
- Rosenberg PS, Socie G, Alter BP, Gluckman E. Risk of head and neck squamous cell cancer and death in patients with Fanconi anemia who did and did not receive transplants. Blood. 2005;105(1):67-73.
- Alter BP. Fanconi’s anemia and malignancies. Am J Hematol. 1996;53(2):99-110.
- Ciccia A, Ling C, Coulthard R, Yan Z, Xue Y, Meetei AR, et al. Identification of FAAP24, a Fanconi anemia core complex protein that interacts with FANCM. Mol Cell. 2007;25(3):331-43.
- Patel KJ, Joenje H. Fanconi anemia and DNA replication repair. DNA repair. 2007;6(7):885-90.
- Ang KK, Harris J, Wheeler R, Weber R, Rosenthal DI, Nguyen-Tan PF, et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med. 2010;363(1):24-35. Epub 2010/06/10.


